微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________
(2)写出“联合制碱法”有关反应的化学方程式:_____________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_________________________
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_________________
2、填空题 工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C······符号标明(请见题后说明)

(1)请写出在图上A、B、C······各玻璃容器中盛放物质的化学式或名称。 A:__________________,B:___________________,C:__________________, D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?_______________________________
3、填空题 技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图所示
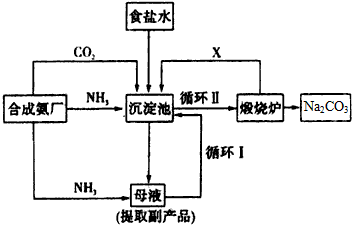
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式),原因是_________________
(2)沉淀池中发生反应的化学方程式是____________________
(3)母液中的溶质主要是________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用是____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环;物质X是__________,从沉淀池中提取沉淀的操作是_______________
(5)写出煅烧炉中发生反应的化学方程式:____________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是__________(填化学式),为检验该杂质的存在,具体操作是________________。
4、选择题 我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
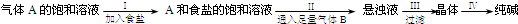
则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
5、选择题 “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是( )
A.
B.
C.
D.