微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2)CO+4OH—-2e-=CO32-+2H2O;
(3) 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)5.6×10-5mol/L;
(5) CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
本题解析:(1)n(CO2)=" 0.4mol" ,n(NaOH)= 0.2L×3mol/L=0.6mol.假设反应后产物中含Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C元素守恒可得x+y=0.4mol;根据Na元素守恒可得2x+y=0.6mol。解得x=y=0.2mol。所以溶液是Na2CO3、NaHCO3等物质的量浓度的混合溶液。根据物料守恒可知离子浓度最大的是c(Na+)。由于二者都要水解消耗水电离产生的H+,所以最终溶液中c(OH-)>c(H+),而CO32-水解的程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-);但是盐的水解程度是微弱的,在溶液中主要还是以盐电离产生的离子存在,盐电离产生的离子浓度远大于弱电解质水的电离产生的离子,所以c(CO32-)>c(OH-)。溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,通入燃料的电极是负极,电极反应方程式为CO+4OH—-2e-=CO32-+2H2O;(3) 由于Fe2+、Fe3+对SO2的转化有催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)假设生成沉淀所需CaCl2溶液的最小浓度为x,由于溶液等体积混合时各种物质的浓度都减小一半,所以 (x/2)×[(2×10—4mo1/L)÷2]≥2.8×10—9=5.6×10-5mol/L;(5)①+②÷2+③×2,整理可得:CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
考点:考查微粒浓度的比较、燃料电池电极反应式和离子方程式、热化学方程式的书写的知识。
本题难度:困难
2、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
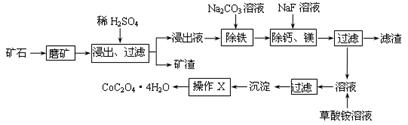

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
参考答案:(1)12 ; 90 ; (2)3,6,6,1,5,6;(3)1.50;
(4)SO42-、NH4+、Na+、F-; 洗涤、干燥 ;(5)0 ;7g
本题解析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、F-离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。
考点:考查物质制备条件的选择、化学方程式的配平、在溶液中离子浓度的关系、混合物分离的操作、锂离子电池的工作原理的知识。
本题难度:困难
3、选择题 关于图中各装置的叙述不正确的是( )
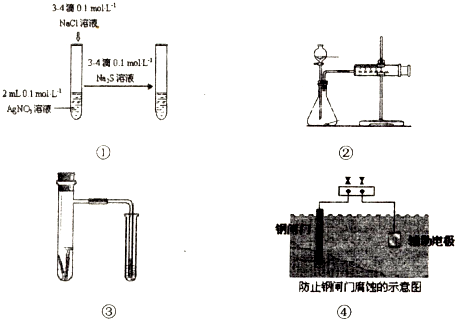
A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B.装置②能测量锌与硫酸的反应速率
C.装置③能验证铁的吸氧腐蚀
D.装置④的X电极是负极,则能验证外接电源的阴极保护法
参考答案:A.硝酸银过量,可与硫化钠反应生成硫化银沉淀,不能证明AgCl沉淀可转化为溶解度更小的Ag2S沉淀,如要证明,应在AgCl饱和溶液中加入硫化钠,故A错误;
B.装置②能测量锌与硫酸的反应速率,故B正确;
C.吸氧腐蚀消耗氧气,具支试管内压强减少,小试管液面上升,故C正确;
D.装置③为外加电源的阴极保护法,钢闸门与外接电源的负极相连,电源提供电子而防止铁被氧化,故D正确;
故选A.
本题解析:
本题难度:简单
4、填空题 某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1mol
HCl、0.1mol MgCl2、1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1L。测得部分实验数据如下表

试回答:
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现__________(填“能”或“否”),由此你得到的初步结论是_______________________________。
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
参考答案:(1)否;Mg2+在弱碱性溶液中不能生成沉淀或Mg(OH)2存在溶解平衡
(2)pH=10时,溶液中c(Mg2+)=10-3mol/L,c(AlO2-)=0.1 mol/L 向混合溶液中加入NaOH溶液反应过程分为三个阶段:
H+ + OH- = H2O
0.1mol 0.1mol
Mg2+ + 2OH- =Mg(OH)2↓
0.099mol 0.198mol
Al3+ + 3OH- = Al(OH)3↓
1mol 3mol
Al(OH)3 + OH- =AlO2-+2H2O
0.1mol 0.1mol
根据反应方程式计算,NaOH的质量为(0.1mol+0.198mol +3mol +0.1mol)×40g/mol=135.92g
本题解析:
本题难度:困难
5、选择题 已知Ksp(PbCl2)=1.6×10-5,Ksp(PbI2)=7.1×10-9,Ksp(PbS) =8.0×10-28。若沉淀过程中依次看到白色 PbCl2、黄色PbI2和黑色PbS三种沉淀,则往Pb2+溶液中滴加沉淀剂的次序是
[? ]
A. Na2S、NaI、NaCl
B. NaCl、NaI、Na2S
C. NaCl、Na2S、NaI
D. NaI、NaCl、Na2S
参考答案:B
本题解析:
本题难度:一般