微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi。关于该电池的推论错误的是

A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-=xLi+
C.充电时,有电能转化为化学能
D.充电时,负极(C)上锂元素被氧化
参考答案:D
本题解析:A、放电相当于原电池,Li+主要从负极区通过隔膜移向正极区,A正确;B、放电时Li被氧化,为原电池的负极,电极反应式为xLi-xe-=xLi+,B正确;C、充电时,为电解池反应,电能转化为化学能,C正确;D、由反应LiC002=Li1-xC002+xLi可知,充电时,阴极发生还原反应,生成Li,被还原,D错误,答案选D。
考点:考查电化学原理的应用
本题难度:一般
2、选择题 用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液中加入0.1mol碱式碳酸铜晶体(不含结晶水 ),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )
A.电解过程产生的气体体积(在标准状况下)为5.6L
B.电解过程转移的电子数为3.612×1023个
C.加入碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
D.电解过程只发生了2CuSO4+2H2O
2Cu+O2↑+2H2SO4
参考答案:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O通电.2Cu↓+O2↑+2H2SO4,
第二阶段:2H2O通电.2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO?H2O?CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以解过程中共转移的电子数为0.4mol+0.2mol=0.6mol;
A、电解分为两步电解硫酸铜和水生成氧气0.1mol,电解0.1mol水生成0.1mol氢气和0.05mol氧气,共生成气体0.15mol+0.1mol=0.25mol,气体标准状况体积=0.25mol×22.4L/mol=5.6L,故A正确;
B、上述分析计算可知电子转移总数为0.6mol,电解过程转移的电子数=0.6mol×6.02×1023=3.612×1023个,故B正确;
C、加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O,故C正确;
D、电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O通电.2Cu↓+O2↑+2H2SO4,第二阶段:2H2O通电.2H2↑+O2↑,故D错误;
故选D.
本题解析:
本题难度:一般
3、填空题 江苏拥有较长的海岸线,浩瀚的海洋是一个巨大的物质宝库。目前世界各国都在研究如何充分利用海洋资源。 如下图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过, 阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图中膜a应选用____膜。
②电渗析法还可用来处理电镀废液,写出用该方法处理含硝酸银废液时所发生反应的化学方程式___ 。
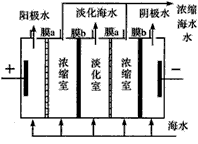
参考答案:①阳离子交换膜;②4AgNO3+2H2O 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
本题解析:
本题难度:一般
4、填空题 (8分)电浮选凝聚法是工业上采用的一种处理污水方法,下图是电解污水实验装置示意图。接通直流电源后一段时间,在A电极附近有深色沉淀物沉积下来,在B电极附近有气泡产生。气泡可将污水中的悬浮物带到水面形成浮渣层,积累到一定厚度时刮去浮渣层,即起到了浮选净化的作用。
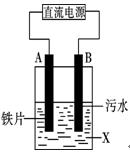
试根据以上实验现象以及图示回答下列问题:
(1)电解池的电极A、B极性分别为?、?(填 “阴极”、“阳极” )
(2)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的?。
a.H2SO4? b.BaSO4? c.Na2SO4? d.NaOH? e.CH3CH2 OH
OH
(3)电解池阳极的电极反应分别是①?;②4OH-- 4 e-= 2H2O +O2↑。
(4)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是?。
参考答案:
本题解析:略
本题难度:一般
5、填空题 (13分)按下图装置进行实验,并回答下列问题。
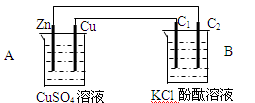
(1)判断装置的名称:A池为___________B池为______________
(2)锌极电极反应式为_________________________
石墨棒C1电极反应式为________________________
石墨棒C2附近发生的实验现象为______________________________
(3)当C2极析出224mL气体(标准状况)时,CuSO4溶液的质量增加_________g。
参考答案:(13分)(1)原电池;电解池
(2)Zn-2e-=Zn2+; 2Cl--2e-= Cl2; C2上有气泡产生且其周围溶液颜色由无色变为浅红(或变为红色,两个现象各1分,意思对即给分)
(3)0.01(3分)
本题解析:(1)A中存在Zn与硫酸铜的反应,所以A为原电池,则B为电解池;
(2)A中Zn比Cu活泼,所以Zn做原电池的负极,发生氧化反应,失去电子生成锌离子,则电极反应式为Zn-2e-=Zn2+;石墨C1与原电池的正极相连,则石墨C1为阳极,发生氧化反应,氯离子失去电子生成氯气,电极反应式为2Cl--2e-= Cl2;则石墨C2为阴极,发生还原反应,氢离子得到电子生成氢气,则氢氧根离子的浓度增大,所以石墨C2附近有气泡产生且溶液变红色;
(3)当C2极析出224mL气体(标准状况)时,即产生0.224L/22.4L/mol=0.01mol氢气时,转移电子的物质的量是0.02mol,A中每转移2mol电子,有65g锌离子进入溶液,则有64gCu析出,溶液质量增加1g,CuSO4溶液的质量增加,所以转移0.02mol电子时,硫酸铜溶液的质量增加0.01g。
考点:考查电化学反应原理的判断
本题难度:一般