微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
周期
| ⅠA
|
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
|
2
|
|
|
| ②
| ③
| ④
|
|
|
3
| ⑤
|
| ⑥
|
|
| ⑦
| ⑧
|
|
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: 。
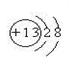
参考答案: (1)
(1) 
(2) (或32S) …… 1分
(或32S) …… 1分
(3)S2->O2-> Na+ …… 1分
(4)H2CO3? HCO3- + H+ HCO3- ? CO32- + H+ …… 1分(只写一步也给分)
(5) …… 1分
…… 1分
(6)CH4-8e-+10OH-= CO32-+7H2O …… 2分
(7)N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g) ΔH="-1676" kJ/mol …… 2分
本题解析:(1)⑥元素为第三周期第三主族元素铝,原子序数为13,其离子结构示意图为
(2)元素⑦为S元素,质子数和中子数相等,则质量数是32,其同位素符号是 (或32S),
(或32S),
(3)④、⑤、⑦的离子分别是O2-、Na+、S2-,根据半径的大小主要由电子层数、核电荷数决定,电子层数越多半径越大,核电荷数越多半径越小,所以3种离子的半径大小顺序为S2->O2-> Na+,
(4)②为碳元素,最高价氧化物对应水化物为碳酸,属于弱酸,其电离方程式为:H2CO3? HCO3- + H+ HCO3- ? CO32- + H+,
(5)④、⑤两种元素分别为氧、钠元素,原子按1:1组成的化合物为Na2O2,其电子式为
(6)由表中两种元素形成的5核10电子分子应是CH4,该电池在碱性条件下的负极反应式为:CH4-8e-+10OH-= CO32-+7H2O
(7)A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料,则A为N2H4, B是一种常见强氧化剂,则B为H2O2, 根据所给数据可得A与B反应的热化学方程式:N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g) ΔH="-1676" kJ/mol
考点:考查元素周期表与原子结构、化学键、电离、化学反应与能量、燃料电池等相关知识的综合应用。同时考查学生分析问题解决问题的能力
本题难度:困难
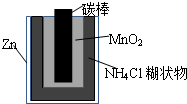
2、简答题 Zn-MnO2干电池应用广泛,其示意图如下,电解质溶液是ZnCl2-NH4Cl混合溶液.
(1)该电池的负极材料是______.电池工作时,电子流向______(填“正极”或“负极”).
(2)如果该电池的工作原理为:Zn+2NH4Cl=ZnCl2+2NH3+H2,其正极反应式为:______
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是______.欲除去Cu2+,最好选用下列试剂中的______(填代号).
a.NaOHb.Zn c.Fed.NH3?H2O
(4)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阴极的电极反应式是:______;若电解电路中通过2mol电子,MnO2的理论产量为______.
参考答案:(1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极,
故答案为:Zn(或锌);正极;
(2)正极上是阳离子的电子发生还原反应的过程,该反应为2NH4++2e-=2NH3+H2,
故答案为:2NH4++2e-=2NH3+H2;
(3)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+置换为单质而除去,
故答案为:锌置换出铜,Zn+Cu2+=Cu+Zn2+,在溶液中,构成铜锌原电池,加快化学反应速率;b;
(4)阴极上得电子,发生还原反应,H+得电子生成氢气,因为MnSO4~MnO2~2e-,通过2mol电子产生1molMnO2,其质量为87g,
故答案为:2H++2e-→H2;87g.
本题解析:
本题难度:一般
3、选择题 在用锌片、铜片和稀硫酸组成的原电池装置中,经过一段时间后,下列说法正确的是(?)
A.铜片上有气泡产生,发生还原反应
B.锌是负极,发生还原反应
C.电流方向是从锌片沿导线流向铜片
D.铜片逐渐溶解,被氧化
参考答案:A
本题解析:考查原电池的判断和应用。原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极方向移动,正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,氢离子在正极得到电子生成氢气。所以答案选A。
本题难度:一般
4、计算题 (9分)有电解装置如图4-37。图中B装置盛1 L 2 mol·L-1 Na2SO4溶液,A装置中盛?1 L 2 mol·L-1 AgNO3溶液。通电后,润湿KI淀粉试纸的C端变蓝色,电解一段时间后,试回答:
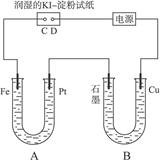
图4-37
(1)A中发生反应的化学方程式为______________________________。
(2)在B中观察到的现象是_________________________。
(3)室温下,若从电解开始到时间为t时,A、B装置中共收集到气体0.168 L(标准状况),若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液的pH为_______。
参考答案:(1)4AgNO3+2H2O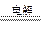 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(2)石墨电极表面有气泡产生,铜电极周围溶液变蓝色,一段时间后U形管下部有蓝色沉淀产生? (3)2
本题解析:C端变蓝说明发生了反应2I--2e-====I2,使淀粉变蓝,故C端为阳极,D端为阴极,据此亦可确定电源的正、负极,及A、B的阴、阳极。对于B,石墨为阴极,发生2H++2e-====H2↑并产生OH-,而Cu为阳极,故不断溶解。对于A,Fe为阴极,有Ag析出,Pt为阳极有O2产生。由于产生的O2为H2的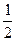 ,故O2的物质的量为
,故O2的物质的量为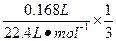 ="0.0025" mol,同时会使A中H+变为4×0.0025 mol="0.01" mol,所以A中c(H+)="0.01" mol·L-1,pH=2。
="0.0025" mol,同时会使A中H+变为4×0.0025 mol="0.01" mol,所以A中c(H+)="0.01" mol·L-1,pH=2。
本题难度:简单
5、选择题 下图各装置中,可以构成原电池的是
[? ]
A.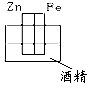
B.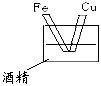
C.
D.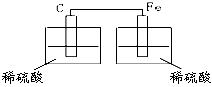
参考答案:C
本题解析:
本题难度:简单