微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某些高档点心的包装盒内有个小纸袋,将小纸袋打开,可看到灰黑色粉末,其中有些已变成棕褐色.将灰黑色粉末溶于盐酸,取上层清液,滴入几滴氯水,再滴入KSCN溶液,马上出现红色.以下结论不?正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.小纸袋中可能装有活性铁粉
C.小纸袋中的原装粉末可能是Fe2O3
D.该灰黑色粉末不可食用
参考答案:C
本题解析:
本题难度:简单
2、计算题 (6分) 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
参考答案:⑴ Fe:5.6g? FeO:3.6g? 3分?⑵ 1? mol/L? ? 3分
本题解析:n=V/Vm=0.1mol
Fe+H2SO4==FeSO4+H2 ↑
1? 1
n Fe? 0.1mol
所以n Fe="0.1" mol,mFe=5.6g,? mFeo=9.2g-5.6g=3.6g,? nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1? mol/L
本题难度:一般
3、填空题 (12分)K2EO4(E代表某种元素)是一种不常见的含氧酸盐,但在工业上有重要的应用,以下是制备该物质的工艺流程图:
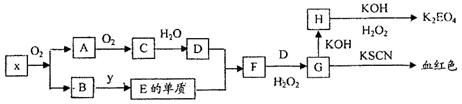
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是?,H的化学式是??。
(2)写出F→G的离子反应方程式??
(3)要实现B→E的转化,y的化学式可能是?
(4)H→K2EO4过程中H2O2的作用?,lmol H转化为K2EO4时需H2O2的物质的量是?。?
参考答案: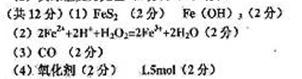
本题解析:略
本题难度:一般
4、选择题 下列关于铁元素的叙述中正确的是( )
A.2Fe3++Cu===2Fe2++Cu2+成立说明氧化性:Fe3+> Cu 2+
B.25℃,pH=0的溶液中,Al3+、NH4+、NO3—、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变红色
参考答案:A
本题解析:A、反应中Fe3+做氧化剂 Cu 2+是氧化产物。根据氧化还原反应的氧化性判断规律,氧化性:氧化剂>氧化产物,所以A正确。故选A。
B、pH=0的溶液中,溶液含有较大浓度的H+,NO具有强氧化性与还原性的Fe2+不能大量共存。
C、5.6gFe为0.1mol与氯气反应时被氧化成Fe3+失去电子为0.3mol。故C错误。
D、硫酸铁溶液中加入铁粉,Fe3+不一定反应完全,滴加KSCN溶液有可能变红色。D错误。
点评:掌握铁及其化合物的相关性质是解题的关键。
本题难度:一般
5、填空题 (本题6分)
⑴电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是? __,证明Fe3+存在的现象是? __。]②写出FeCl3溶液与金属铜发生反应的化学方程式:?。
⑵ 3Cl2?+ 6NaOH? ="=?" 5NaCl + NaClO3?+ 3H2O
氧化剂与还原剂的物质的量之比为?,氧化产物是? ________。
参考答案:①KSCN溶液,溶液变成血红色。
②? 2FeCl3 + Cu = 2FeCl2 + CuCl2
⑵ 5:1;? NaClO3。
本题解析:略
本题难度:一般