微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某工厂化验室为测定某黄铁矿(主要成分是FeS2)的纯度,取1.00 g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧,完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%,吸收塔中SO3完全吸收。若煅烧10 .0t上述黄铁矿,则可制得98%的硫酸多少吨?
参考答案:(1)75%(2分);(2)9.8t(2分)
本题解析:略
本题难度:一般
2、填空题 (14分)回答下列关于铁元素及其化合物的知识:
(1)向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为 _________________,
其中含铁元素的产物的化学式是___________________ ;
(2)为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明。方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理 __________________ ;
②写出Fe2+与氯气反应的离子方程式 ____________________________;
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,
其原因是(用离子方程式表示)__________________________________________
(4)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被______ ;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有_______。
A.氧化性
B.还原性
C.酸性
D.碱性
参考答案:(1)红褐色沉淀? Fe(OH)3;
(2)①方案二
②2Fe2++ Cl2? =? 2Fe3+ + 2Cl-
③2Fe3+ + Fe? = 3Fe2+
(4)被氧化 ?B
本题解析:遇KSCN溶液呈血红色是Fe3+的特征反应,根据Fe3+的特征反应先加KSCN溶液,确定是否含有Fe3+;如果没有Fe3+,根据氯水的性质,再向溶液中加入氯水,观察溶液的颜色是否变化,从而确定是否含有Fe2+。
Fe2+与KSCN溶液反应无血红色出现,但Fe3+与KSCN反应产生血红色,因此,要证明某溶液中有无Fe2+,则先要在溶液中加入KSCN溶液,没有出现血红色,再向其中加入氯水出现血红色,则证明原溶液中含Fe2+。
点评:本题考查了Fe2+的检验方法,Fe2+呈中间价态,既有氧化性又有还原性,能被氯水等强氧化剂氧化成Fe3+,利用Fe3+的特征反应检验Fe2+的存在是较好的方法,但首先要排除Fe3+的干扰。
本题难度:一般
3、选择题 把Fe和Al的混合物溶于过量的稀盐酸,向所得溶液中加入过量的NaOH溶液,有沉淀a生成。过滤,向滤液中通入过量的CO2气体后得到沉淀b ,加热沉淀b至质量不再发生变化,得到残渣。上述沉淀a、沉淀b和残渣分别为?(?)?
A.Fe(OH)3; Al(OH)3; Al2O3
B.Al(OH)3; Fe(OH)3; Fe2O3
C.Fe(OH)3 Al(OH)3; Fe(OH)3 Al(OH)3; Fe2O3 Al2O3
D.Al(OH)3; Fe(OH)3; Al2O3
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
⑵除去蒸馏水中溶解的O2常采用________的方法。
⑶?生成白色Fe?(OH?)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
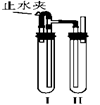
方法二:如右图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑷在试管Ⅰ里加入的试剂是____________。
⑸在试管Ⅱ里加入的试剂是____________。
⑹这样生成的Fe?(OH?)2沉淀能较长时间保持白色,其理由是____________________________。
参考答案:
⑴稀硫酸?铁粉?⑵ 煮沸?⑶ 避免生成的Fe(OH)2沉淀接触空气
⑷稀硫酸?铁粉?⑸? NaOH溶液?
⑹试管Ⅰ中反应生成的H2充满了试管Ⅱ。且外界空气不容易进入
本题解析:(1)还需加入稀硫酸来抑制二价铁离子的水解。以及加入铁粉,使被氧化的二价铁离子还原。(2)一般使用煮沸即可。(3)如果是从液面以上来滴加,液滴会将空气中的氧气带入到溶液中,将二价铁离子氧化。所以需要无氧气的溶液,和伸入液面以下来滴加液体。(4)装置中I为制备硫酸亚铁的装置,使用的试剂为铁和稀硫酸。(5)而装置Ⅱ中加入的是氢氧化钠。(6)在装置I 中既生成了亚硫酸铁,还生成了氢气,排入到装置Ⅱ,防止空气进入。而装置I中加入的稀硫酸和铁粉也能抑制亚铁离子的水解和氧化。
点评:本题属于常规考题,在制备氢氧化铁实验中关键在于抓住防止亚铁离子氧化。
本题难度:一般
5、选择题 将等质量的铜片在酒精灯上加热后,分别加入下列溶液中,放置片刻,最终铜片质量增加的是( )
A.石灰水
B.无水乙醇
C.硝酸
D.盐酸
参考答案:A
本题解析:先根据铜片在酒精灯上加热生成CuO,质量增加,然后考虑表面的氧化铜与选项中的物质是否反应,确定铜片质量如何变化。
铜片在酒精灯上加热后生成CuO,质量增加,将它投入石灰水中,氧化铜不与石灰水反应,铜片质量增加,故A正确;铜片在酒精灯上加热后生成CuO,质量增加,将它投入无水乙醇中,发生反应:CH3CH2OH+CuO CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。
CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。
点评:该题是中等难度的试题,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑思维能力和抽象思维能力。该题的关键是明确有关物质的化学性质和反应的原理,然后结合题意灵活运用即可。
本题难度:简单