微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (15分)铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理___________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
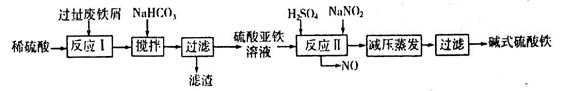
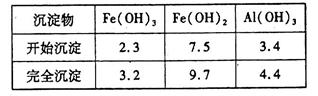
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
参考答案:Ⅰ、(1)FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的(2分)
(2)①Fe +2 Fe3+="=3" Fe2+(1分)? Fe +2H+="=" Fe2+ + H2↑(1分)
②4.4~7.5(2分)? ③69(2分)? ④2[Fe(OH)] 2+ + 2H2O [Fe2(OH)4] 2+ +2H+(2分)
[Fe2(OH)4] 2+ +2H+(2分)
Ⅱ、LiFePO4-e-="=" FePO4+Li+(2分)? 14(3分)
本题解析:Ⅰ、(1)FeO42-中铁的化合价是+6价,具有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的。
(2)①根据废铁屑中的成分可知,应I中发生的氧化还原反应的离子方程式Fe +2 Fe3+="=3" Fe2+、Fe +2H+="=" Fe2+ + H2↑。
②调节pH的目的是沉淀铝离子,所以根据阳离子以氢氧化物形式沉淀时溶液的pH可知,溶液的pH应控制在4.4~7.5。
③5.6L O2(标准状况)的物质的量是0.25mol,转移电子是1mol。由于亚硝酸钠的还原产物是NO,所以可节约1mol亚硝酸钠,其质量是69g。
④根据反应物和生成物可知,水解方程式为2[Fe(OH)] 2+ + 2H2O [Fe2(OH)4] 2+ +2H+。
[Fe2(OH)4] 2+ +2H+。
Ⅱ、充电时阳极失去电子,所以方程式为LiFePO4-e-="=" FePO4+Li+。1.4g Li转移的电子是0.2mol,所以根据方程式2NaCl+2H2O H2↑+Cl2↑+2NaO可知,生成氢氧化钠是0.2mol,即氢氧化钠的浓度是1.0mol/L,所以pH=14。
H2↑+Cl2↑+2NaO可知,生成氢氧化钠是0.2mol,即氢氧化钠的浓度是1.0mol/L,所以pH=14。
本题难度:一般
2、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL?4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
A.0.24mol
B.0.21mol
C.0.25mol
D.0.12mol
参考答案:B
本题解析:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=1.344L÷22.4L/mol=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为(0.48mol-0.06mol)÷2==0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,故选B。
本题难度:一般
3、选择题 下列有关Fe2+和Fe3+的叙述中,错误的是
A.Fe2+的水溶液呈无色
B.Fe3+的水溶液呈黄色
C.Fe2+既有氧化性又有还原性
D.Fe3+的水溶液中滴入KSCN试剂后,立即出现血红色
参考答案:A
本题解析:A?错Fe2+的水溶液呈浅绿色
本题难度:简单
4、简答题 如图所示,将图1、图2两个装有不同物质的针筒用导管连接起来,将图2针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同).
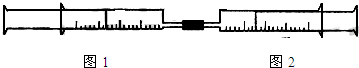
试回答下列问题:
| 实验序号 | 图1针筒内物质 | 图2针筒内物质 | 图1针筒的现象
1
10mLFeSO4溶液
10mLNH3
生成白色沉淀,后变色
2
10mL1mol/LAlCl3溶液
40mL1mol/LNaOH溶液
______
3
10mL紫色石蕊试液
25mLCl2
______
4
15mLCl2
40mLNH3
______
|
(1)实验1中,沉淀最终变为______色,写出沉淀变色的化学方程式______.
(2)实验2图1针筒内的现象是:______,写出有关反应的离子方程式:______、______.
(3)实验3图1针筒内的现象是:______,反应后图2针筒内有少量的残留气体,正确的处理方法是将其通入______溶液中.
(4)实验4中,已知:3Cl2+2NH3=N2+6HCl.图1针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为______.
参考答案:(1)NH3+H2O?NH3?H2O?NH4++OH-,FeSO4+2NH3?H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2为白色沉淀,在空气中易被空气中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O═4Fe(OH)3,Fe(OH)3为红褐色,
故答案为:红褐,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)10mL1mol/L的AlCl3溶液与40mL1mol/L的NaOH溶液反应,0.01molAlCl3与0.04molNaOH?反应,根据?
? Al3++3OH-=Al(OH)3↓? Al(OH)3 +OH?-=AlO2-+2H2O
?0.01mol? 0.03mol?0.01mol?0.01mol?0.01mol?0.01mol?
? 现象为:先有白色沉淀,后沉淀溶解.
故答案为:先有白色沉淀,后沉淀溶解、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(3)Cl2+H2O?HCl+HClO,HCl和HClO均具有酸性,能使紫色石蕊试液变红,HClO具有强氧化性,能漂白指示剂红色褪去.Cl2+2NaOH═NaCl+H2O+NaClO
多余氯气用NaOH吸收.
故答案为:先变红后褪色、NaOH;
(4)根据方程式可知:3Cl2+2NH3═N2+6HCl?
? 15mL? 10mL? 5mL? 30mL
生成30mLHCl,剩余的NH3为30mL,
由NH3+HCl═NH4Cl?
?30mL? 30mL?
可知,生成的HCl与剩余的NH3恰好完全反应生成NH4Cl,随着反应的进行,Cl2的量逐渐减少,最终完全反应.
所以最后剩余的气体为5mL无色的N2.
故答案为:黄绿色变为无色.
本题解析:
本题难度:一般
5、选择题 将3.20 g Cu跟10.0 mol/L的硝酸30.0 mL充分反应,还原产物中有NO和NO2 。若反应后溶液中有a mol H+,则此时溶液中NO3- 的物质的量为
A.a/2 mol
B.2a mol
C.0.100 a mol
D.(a + 0.100) mol
参考答案:D
本题解析:由守恒关系可知:铜最终只能转化成硝酸铜,3.20 g Cu的物质的量是0.05mol,所以硝酸铜中的硝酸根是0.1mol。根据氢元素守恒可得,为何铜离子结合的硝酸根是a mol,所以溶液中NO3- 的物质的量为(a + 0.100) mol,故选D。
点评:本题重点考查的是有关硝酸氧化性的知识,考查学生对课本知识的掌握情况和计算能力。
本题难度:简单