| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2017年模拟版)(八)
参考答案:D 本题解析:电解质为在水溶液或熔融状态下能导电的化合物。AB单质既不是电解质也不是非电解质;C为非电解质;答案为D。 本题难度:一般 3、选择题 下列说法中,正确的是 |
参考答案:B
本题解析:A.常温下,某NaHSO3溶液的pH<7,说明亚硫酸氢根的水解程度小于电离程度,则该溶液中c(SO32-)>c(H2SO3),A错误;B.醋酸钠是强碱弱酸盐,水解显碱性,则25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7时醋酸过量,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液),B正确;C.醋酸是弱酸,存在电离平衡。稀释促进电离,则将l mL pH=2的醋酸溶液加水稀释到10 mL,pH小于3,C错误;D.常温下,将Na2CO3溶液加水稀释促进碳酸根的水解,当温度不变,水解常数不变,所以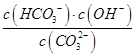 的值不变,D错误,答案选B。
的值不变,D错误,答案选B。
考点:考查弱电解质的电离、盐类水解等
本题难度:一般
4、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L CH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—)
C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S)
参考答案:D
本题解析:A项,考查物料守恒,CH3COOH部分电离产生CH3COO-和H+,醋酸根原子团守恒,得c(CH3COO-)+ c(CH3COOH)=0.1mol/L。B项,根据电荷守恒关系式C(Na+)+ c(H+)= 2 c(CO32—)+ c(HCO3—)+ c(OH-)和物料守恒关系式c(Na+)= c(CO32—)+ c(HCO3—)+ c(H2CO3),可计算得到c(OH-) = c(H+) + c(H2CO3)-c(CO32—)。C项,CH3COO-水解显碱性,所以c(Na+)> c(CH3COO-),c(OH-)> c(H+)。因为OH-是水解产生的,量很小,所以c(OH-)> c(H+)排在后边。D项,考查的物料守恒,c(Na+)=2 c(S)=2(c(S2—) + c(HS—)+ c(H2S))
本题难度:困难
5、选择题 100mL0.1 mol·L-1 NaOH溶液与100mL0.1 mol·L-1 CH3COOH溶液混合后,溶液中离子浓度关系正确的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+ c(OH-)= c(CH3COO-)+ c(H+)
D.c(Na+)+ c(H+) = c(CH3COO-)+ c(OH-)
参考答案:D
本题解析:醋酸和氢氧化钠恰好反应,生成的醋酸钠水解显碱性。AB不正确,根据电荷守恒可知,D正确,C不正确,答案选D。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《与量有关的离子方.. | ||