微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 起固定氮作用的化学反应是(? )
A.N2与H2在一定条件下反应生成NH3
B.NO遇O2转化为NO2
C.硝酸工厂用NH3氧化制NO
D.由NH3制碳酸氢铵和硫酸铵
参考答案:A
本题解析:固氮是指氮由游离态转化为化合态,故答案选A。
本题难度:简单
2、选择题 下列关于浓HNO3与浓H2SO4的叙述正确的是
A.露置于空气中,溶液浓度均降低
B.常温下都能与铜较快反应
C.在加热时都容易分解
D.常温下都不可用铁制容器贮存
参考答案:A
本题解析:浓硝酸易挥发,浓硫酸易吸水,所以浓度都降低,A正确。浓硫酸和铜反应需要加热,B不正确。浓硫酸稳定,难分解,C不正确。铁在常温下在二者中都发生钝化,可用铁制容器贮存,D不正确。答案选A。
本题难度:简单
3、填空题 (16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
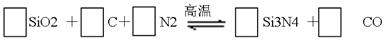
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是?,其还原产物是?;
(3)该反应产生标准状况下11.2升CO气体,则电子转移?摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移?(填大于、等于或小于)2摩尔,理由是?。
参考答案:
(1)3,6,2,1,6 (4分)
(2)N2(2分),Si3N4(2分)
(3)1 (3分)
(4)小于(2分)?可逆反应不能进行到底(3分)。
本题解析:略
本题难度:简单
4、选择题 取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体a L,将气体用足量的水吸收,剩余气体B的体积为a/6? L。下列相关推测正确的是
A.NO2与O2的体积比为5:1
B.气体B可能是NO2
C.NO2与O2的体积比为2:1
D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1
参考答案:CD
本题解析:根据所学硝酸盐加热分解相关知识可知,按金属活动性顺序有:K、Ca、Na形成的硝酸盐加热分解生成亚硝酸盐和O2;Mg至Cu形成的硝酸盐加热分解生成高价金属氧化物、NO2和O2;Hg至Au形成的硝酸盐加热分解生成金属单质、NO2和O2。
据此有:2KNO3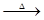 2KNO2+O2↑
2KNO2+O2↑
2Cu(NO3)2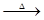 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3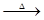 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
由题可知,生成气体被水吸收后体积减小,则说明气体A中一定含有NO2,而根据方程式可知,有NO2生成时肯定伴随O2生成,且n(NO2):n(O2)≤4:1。根据NO2、O2与水反应方程式(4NO2+O2+2H2O→4HNO3)可知NO2肯定能被全部吸收,剩余气体中只有O2,所以B错误。减少的气体体积为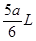 ,其中n(NO2):n(O2)=4:1,则说明NO2占了原气体体积的4/6,加之剩余的a/6L全为O2,O2占了原气体体积的2/6,所以A气体中n(NO2):n(O2)=4:2=2:1,所以A错误,C正确。
,其中n(NO2):n(O2)=4:1,则说明NO2占了原气体体积的4/6,加之剩余的a/6L全为O2,O2占了原气体体积的2/6,所以A气体中n(NO2):n(O2)=4:2=2:1,所以A错误,C正确。
又由上述硝酸盐分解的方程式可知,若生成气体满足n(NO2):n(O2)=2:1,且三种盐都含有时,AgNO3的含量可以是任意值,Cu(NO3)2和KNO3的物质的量之比必须满足1:1,所以D正确。
本题难度:一般
5、选择题 (12分)小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
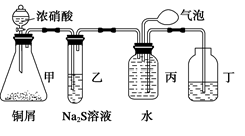
(1)写出甲中反应的离子方程式___________________________________________,乙中的现象是_______________________________,可证明NO2的氧化性;在丙中鼓入空气后现象是?,可证明NO的还原性。
(2)实验前丙中充满水的作用是_________________________________________。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是?。
你认为怎样才能准确证明NO2的氧化性?(简要回答出原理和现象即可)_______________________________________________________________________ 。
参考答案:(12分,每空2分)
(1)Cu+4H++2NO===Cu2++2NO2↑+2H2O ?溶液变浑浊 ?有红棕色气体生成
(2) 制取NO,并用排水法收集NO
(3)NO2和水反应生成的HNO3是一种氧化性酸,可将Na2S氧化,使溶液变浑浊
可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性
本题解析:(1)甲中为铜与浓硝酸反应,其反应的离子方程式为:Cu+4H++2NO===Cu2++2NO2↑+2H2O ;反应生成的NO2气体与Na2S反应生成S沉淀,乙中现象为黄色浑浊;丙中收集要的气体为NO,鼓入空气后生成NO2红棕色气体生成;
(2)NO2气体与水反应生成硝酸和NO,NO气体不溶于水,所以,丙中充满水的作用为制取NO,并用排水法收集NO;
(3)由于NO2气体溶于水后会与水反应生成硝酸和NO,而生成的硝酸具有强氧化性,可将将Na2S氧化,使溶液变浑浊;正确的操作方法为:可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性
本题难度:一般