微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 19.2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11.2 LNO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是(?)
A.0.8 mol
B.1.1 mol
C.1.2 mol
D.2.0 mol
参考答案:B
本题解析:Cu与硝酸反应,开始是浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸变稀,这时发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。可见在反应中硝酸的作用有两个:一是形成Cu(NO3)2;二是得到电子变为气态氧化物NO、NO2。n(Cu)="m÷M" ="19.2g÷" 64g/mol=0.3mol.n(气体)=V÷Vm= 11.2 L÷22.4L/mol=0.5mol.所以n(HNO3)=2n(Cu)+ n(气体)="2×" 0.3mol+ 0.5mol=1.1mol。故选项为B。
本题难度:一般
2、填空题 配平下列化学方程式
(1)______Cu+______HNO3=______Cu(NO3)2+______NO↑+______H2O;
(2)______NaNO2+______HI=______NaI+______NO↑+______H2O+______I2.
参考答案:(1)该反应中元素的化合价变化如下:Cu→Cu(NO3)2,Cu元素的化合价由0价→+2价,一个Cu失去2个电子;
HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4;
(2)该反应中元素的化合价变化如下:NaNO2→NO,N元素的化合价由+3价→+2价,一个NaNO2得到1个电子;HI→I2,I元素的化合价由-1价→0价,一个HI失去1个电子,所以得失电子的最小公倍数为1,所以NaNO2的计量数为1,NaI的计量数为1,I2的计量数为12,由于HI部分被氧化,根据原子守恒,HI的计量数为2,H2O计量数为1,由于I2的计量数为12,各物质的系数同时乘以2.故答案为:2;4;2;2;2;1;
本题解析:
本题难度:一般
3、选择题 将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化关系如图所示。纵坐标是固体的相对质量。下列关于5个温度区间存在的物质及其稳定性或物质发生的变化(用化学方程式表示)的说法不正确的是
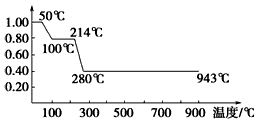
[? ]
A.0~50℃为MnC2O4·2H2O的稳定区域
B.在50~100℃,发生反应为:MnC2O4·2H2O===MnC2O4+2H2O(g)
C.在100~214℃,固体的质量不变,所以为MnC2O4的稳定区域
D.在214~280℃,发生的反应为:MnC2O4===MnO2+2CO↑
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列关于过氧化钙的说法中正确的是?
[? ]
A.过氧化钙和二氧化硫的漂白原理相同
B.在酸性高锰酸钾溶液中加入足量的过氧化钙粉末,溶液紫色褪去
C.过氧化钙与酸反应能生成盐和水,它是碱性氧化物
D.过氧化钙与二氧化碳反应,过氧化钙是氧化剂,二氧化碳是还原剂
参考答案:B
本题解析:
本题难度:一般
5、填空题 (7分)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + ______ → VO2+ + CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+ 和HCl氧化性相对强弱 B.VO2+ 和Cl2氧化性相对强弱 C.上述均不正确.
参考答案:(1)V2O5+H2SO4=(VO2)2 SO4+H2O 不是
(2)2、1、2H+、2、2、2 H2O
(3)0.005NA
(4)B
本题解析:(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液,化学方程式为V2O5+H2SO4=(VO2)2 SO4+H2O;该反应中的各元素的化合价在反应前后未发生变化,所以不是氧化还原反应;
(2)VO2+V的化合价是+5价,产物中V的化合价是+4价,H2C2O4中C的化合价是+3价,二氧化碳中C的化合价是+4价,所以C的化合价整体升高2价,根据氧化还原反应中得失电子守恒,VO2+、VO2+的系数是2,H2C2O4,的系数是1,二氧化碳的系数是2,根据电荷守恒,反应物中的电荷小于产物中的电荷数,所以反应物中的空白应是H+,产物中的空白应是H2O,H+的系数是2,则水的系数是2;
(3)标准状况下气体112毫升,物质的量是0.005mol,即生成0.005mol的二氧化碳,转移电子的物质的量是0.005mol,电子转移的数目为0.005NA
(4)若用盐酸酸化,则盐酸中的氯离子有还原性,所以能否用盐酸酸化,还需知道VO2+ 和Cl2氧化性相对强弱或VO2+与Cl-的还原性的相对强弱,若VO2+ 氧化性强,则不能用盐酸酸化,否则会生成氯气,不能氧化草酸,答案选B。
考点:考查化学方程式的书写,氧化还原反应的判断及配平、计算、氧化还原反应规律的应用
本题难度:一般