微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制Cl2的原理:MnO2+4HCl(浓)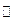 MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
A.4:1
B.1:4
C.1:2
D.2:1
2、选择题 在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2 +2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
[? ]
A.+4价
B.+5价
C.+6价
D.+7价
3、选择题 全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2
A.该反应中Cu2S只是还原剂
B.每生产1molCu需转移2mol电子
C.该反应中Cu2S既是氧化剂又是还原剂
D.若用该反应生产铜,全世界每年产生的SO2的体积(标准状况)约为1.4×106L
4、填空题 把Cl2通入浓氨水中,发生下述反应:3Cl2 + 8NH3 = 6NH4Cl + N2,发生化学反应的Cl2与NH3的分子数之比为: ,反应中发生电子转移的Cl2与NH3的分子数之比为:?
5、选择题 分析如下残缺的反应:RO3- +____+6H+ = 3R2↑+3H2O。下列叙述正确的是
[? ]
A.R一定是周期表中的第VA族元素
B.R的原子半径在同周期元素原子中最小
C.上式中缺项所填物质在反应中作氧化剂
D.RO3-中的R元素在所有的反应中只能被还原