微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下有下列四种溶液:①0.1mol·L-1氨水?②0.1mol·L-1NH4Cl溶液?③含有0.1mol·L-1
盐酸和0.1mol·L-1 NH4Cl的混合溶液?④含有0.1mol·L-1 NaOH溶液和0.1 mol·L-1氨水的混合
溶液,四种溶液中c(NH4+)由小到大排列正确的是
A.②③④①
B.④①②③
C.①④②③
D.③②①④
参考答案:B
本题解析:氨水是弱碱,存在电离平衡;氯化铵是强电解质,完全电离,但氯化铵水解显酸性;盐酸的存在能抑制氯化铵水解;氢氧化钠的存在,能抑制氨水的电离,所以答案选B。
本题难度:一般
2、填空题 (8分)在FeCl3溶液中
(1)氯化铁水解的离子方程式为____________________________________________。
(2)在配制FeCl3溶液时,防止浑浊,应加 入________________________________。
入________________________________。
(3)在FeCl3溶液中加入一定量Na2CO3溶液,产生的现象是________________________,有关反应的离子方程式为_______________________________________________ _______。
_______。
参考答案:(1)Fe3+ + 3H2 O
O 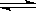 ?Fe(OH)3 + 3H+
?Fe(OH)3 + 3H+
(2) 加入适量盐酸(使溶液变澄清)
(3)反应剧烈,既有红褐色沉淀产生,以有气体生成;
2Fe3+? +? 3CO32-? +? 3H2O? ="?" 2Fe(OH)3↓ +?3CO2↑
本题解析:略
本题难度:一般
3、填空题 聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:

聚合过程主要利用了Al3+的性质是?。
参考答案:水解性
本题解析:略
本题难度:简单
4、选择题 在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO )
)
B.c(OH-)=2c(H+)
C.c(HCO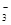 )>c(H2CO3)
)>c(H2CO3)
D.c(Na+)<c(CO )+c(HCO
)+c(HCO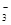 )
)
参考答案:C
本题解析:A.根据物料守恒可得c(Na+)=2c(CO ) +2c(HCO
) +2c(HCO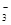 ) +2c(H2CO3),错误;B.由于溶液显碱性,所以根据质子守恒可得:c(OH-)=c(H+)+ c(HCO3-) +2c(H2CO3),错误;C.因为酸的电离程度:H2CO3> HCO3。酸越弱,其离子水解程度就越大,微粒的浓度就越小,所以c(HCO
) +2c(H2CO3),错误;B.由于溶液显碱性,所以根据质子守恒可得:c(OH-)=c(H+)+ c(HCO3-) +2c(H2CO3),错误;C.因为酸的电离程度:H2CO3> HCO3。酸越弱,其离子水解程度就越大,微粒的浓度就越小,所以c(HCO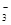 )>c(H2CO3)。正确;D.根据物料守恒可得:c(Na+)=2c(CO
)>c(H2CO3)。正确;D.根据物料守恒可得:c(Na+)=2c(CO )+2c(HCO
)+2c(HCO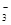 )+2c(H2CO3),所以c(Na+)>c(CO
)+2c(H2CO3),所以c(Na+)>c(CO )+c(HCO
)+c(HCO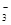 ),错误。
),错误。
本题难度:一般
5、填空题 (1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):_____________________
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是?
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。原因是:_________________(用离子方程式表示);
参考答案:(1)酸,抑制。(2)酸,Al3++3H2O 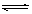 ?Al(OH)3+3H+, Al2O3?;
?Al(OH)3+3H+, Al2O3?;
(3)NaOH。S2-+H2O HS-+OH-?HS-+H2O
HS-+OH-?HS-+H2O H2S+OH-
H2S+OH-
本题解析:(1)硝酸银是强酸弱碱盐,所以AgNO3的水溶液呈酸性;硝酸中氢离子浓度大,所以将AgNO3固体先溶于较浓的硝酸中,可以抑制硝酸银的水解。
(2)氯化铝是强酸弱碱盐,水解显酸性,反应的方程式是Al3++3H2O 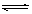 ?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
(3)硫化钠是强碱弱酸盐,硫离子水解显碱性,所以加入少量的氢氧化钠可以抑制硫化钠的水解,有关反应的方程式是S2-+H2O HS-+OH-?、HS-+H2O
HS-+OH-?、HS-+H2O H2S+OH-。
H2S+OH-。
点评:在判断盐溶液的酸碱性时,需要掌握盐类水解的原理及水解的特点。盐类水解遵循:有弱才水解、无弱不水解、都弱都水解,越弱越水解,谁强显谁性。
本题难度:一般