| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《铁的氧化物》考点强化练习(2017年押题版)(四)
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题: 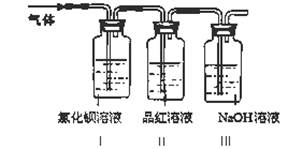 (1)装置I中氯化钡溶液中可观察到现象?。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。 (2)装置II中试剂为品红溶液,其作用是? (3)装置III中试剂为NaOH溶液,其作用是?。 参考答案:【问题1】?(1)KSCN 本题解析:【问题1】(1)绿矾中的亚铁离子被氧化成铁离子,遇KSCN变红色,因此加入KSCN溶液,若溶液变红证明被氧化 本题难度:一般 2、实验题 [2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。 |
参考答案:(11分)(1)①Na2SO3+H2SO4=Na2SO4+SO2↑+H2O?②防倒吸
(2)①500mL容量瓶(无型号不得分)?偏低?②排尽装置中的空气
(3)①D?②SO2也能使高锰酸钾溶液褪色
本题解析:(1)①硫酸的酸性强于亚硫酸,硫酸与亚硫酸反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。②装置B的作用显然是防止倒吸。
(2)①要配制450mL3mol/L的稀硫酸,由于实验室中无450mL的容量瓶,故应选用500mL的容量瓶;配制过程中未洗涤烧杯与玻璃棒,会造成溶质损失,致使所配溶液浓度偏低。②乙同学用H2排尽装置中的空气,以防止发生反应SO2+H2O+O2=H2SO4。
(3)①乙同学设计用H2排尽装置中的空气来改进甲同学的实验,正是对甲同学实验不严谨的改进,因为SO2溶于水生成H2SO3,装置中的O2会把H2SO3氧化成H2SO4。
②丙同学对乙同学实验的改进也正是乙同学实验不够严谨之处,因为Fe2+能使KMnO4溶液褪色,SO2也能使KMnO4溶液褪色。
本题难度:一般
3、选择题 有氧化铁和氧化铜的混合物ag,加入2mol/L的硫酸溶液50mL时,恰好完全溶解。若将等质量这种混合物在氢气中加热并充分反应,冷却后剩余固体的质量为
A.0.8g
B.0.8ag
C.(a—1.6)g
D.(a—0.8)g
参考答案:C
本题解析:将等质量这种混合物在氢气中加热并充分反应,冷却后剩余固体为金属,失去的氧原子的质量与SO42―的物质的量相同,2mol/L×005L=0.1mol,所以C正确,选C。
本题难度:一般
4、填空题 (18分)铁及其他合物在工业生产中有着广泛的应用。请按要求回答下列问题:
I.工业上利用硫酸铁矿烧渣(主要成分为Fe2O3、Al2O3、SiO2等)为原料提取Fe2O3,工艺流程如下图1: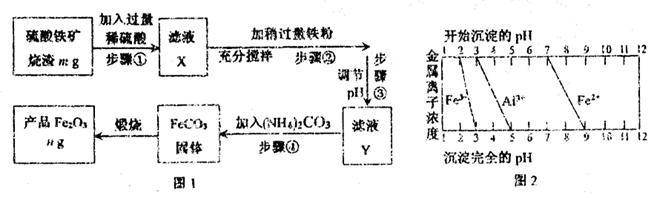
(1)滤液X中所含金属阳离子有?。
(2)步骤②中理论上发生反应的离子方程式依次为?。
(3)结合图2,分析步骤③调节pH的目的是 ?。
(4)假设流程中矿渣中的铁元素100%转化到产品中,则硫酸铁矿烧渣样品中Fe2O3的质量分数范围为(含m、n的代数式) ?。
(5)请设计实验室中以硫酸铁矿烧渣为原料提取氧化铁的另一种方案:向硫酸铁矿烧渣原料中加入过量稀硫酸、充分搅拌、过滤,再向滤液中加入足量的?溶液,接下来的一系列操作是搅拌、?、洗涤、?,最后获得纯净的产品Fe2O3。
Ⅱ.几位同学用铁盐溶液清洗试管中银镜,实验设想如下:
(6)甲:认为含Fe3+的盐无法洗去银镜。依据是Fe3+的氧化性(填“强于”或“弱于”)?Ag+的氧化性,所以反应Fe3++Ag→Fe2++Ag+不可以发生。
(7)乙:查资料发现,用FeCl3溶液可以清洗银镜,于是他亲自动手实验,发现银镜迅速消失,另外还观察到溶液变为浅绿色;为验证Fe3+的还原产物,可选择的试剂为 ?。结合甲的分析和自己的实验现象他得出结论:反应Fe2++Ag→Fe3++Ag是(填“可逆”或“不可逆”) ?反应。
(8)丙:结合甲、乙的设想,他用Fe(NO3)3溶液做对比实验,发现清洗银镜的速率慢许多,他重新观察乙的实验试管中有白色沉淀,于是结合化学平衡理论分析,得出用FeCl3溶液清洗银镜的离子方程式:??。
参考答案:(1)Fe3+、Al3+?(2)2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑ (3)沉淀铝离子
(4)小于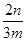 ?×100%?(5)氢氧化钠;过滤;灼烧?(6)弱于
?×100%?(5)氢氧化钠;过滤;灼烧?(6)弱于
(7)铁氰化钾溶液;可逆?(8)Fe3++Ag+Cl-=Fe2++AgCl
本题解析:(1)Fe2O3、Al2O3均能与稀硫酸反应生成硫酸铝、硫酸铁和水,SiO2与稀硫酸不反应,因此过滤后滤液X中主要含有铁离子和铝离子。
(2)滤液中含有过量的稀硫酸以及生成硫酸铁,二者均能与铁反应,反应的离子方程式为2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑。
(3)根据图2可知,随着溶液pH的升高,铝离子首先生成氢氧化铝沉淀,而溶液中的亚铁离子在留在溶液中,因此调节pH的目的是沉淀铝离子。
(4)根据流程图可知,在滤液X中加入铁粉时生成亚铁离子引入了铁元素。所以最终生成的氧化铁质量大于原矿石中氧化铁的质量。如果加入的铁粉恰好只与铁离子反应,则n值最小,此时得出的矿石中氧化铁的含量最高。设原矿石中氧化铁的物质的量是amol,则滤液X中铁离子的物质的量是2amol,根据方程式2Fe3++Fe=3Fe2+可知生成亚铁离子的物质的量是3amol,因此最终生成的氧化铁的物质的量是1.5amol,即160×1.5amol=n,解得a=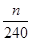 ,所以原矿石中氧化铁的含量为
,所以原矿石中氧化铁的含量为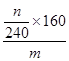 ?×100%=
?×100%=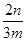 ×100%,因此样品中Fe2O3的质量分数范围为小于
×100%,因此样品中Fe2O3的质量分数范围为小于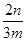 ×100%。
×100%。
(5)由于氢氧化铝是两性氢氧化物,因此要从滤液X中获得氧化铁,则可以加入过量的氢氧化钠溶液,过滤后得到氢氧化铁,洗涤后灼烧即可。
(6)根据金属活动顺序表可知,铁离子的氧化性弱于银离子的氧化性。
(7)铁离子的还原产物是亚铁离子,因此为验证Fe3+的还原产物,可选择的试剂为)铁氰化钾溶液;由于铁离子的氧化性弱于银离子的氧化性,而反应Fe2++Ag→Fe3++Ag可以发生,这说明反应应该是可逆反应。
(8)根据以上分析可知,硝酸铁溶液与银镜反应很慢,与氯化铁溶液反应快,这说明由于在反应中生成的银离子与氯离子结合生成了难溶性物质氯化银,从而促使平衡向正反应方向移动,反应的方程式为Fe3++Ag+Cl-=Fe2++AgCl。
本题难度:困难
5、计算题 将盛有12gCuO的试管通入氢气后加热,当冷却后试管内的固体残渣为10g时,求氧化铜被还原的质量分数?
参考答案:83.3%
本题解析:此题经分析,12gCuO没有完全反应,生成物的残渣10g中也有没有反应的CuO。用常规解法较烦琐,如果用差量法则较为简便。但一定要分析清楚,减重的质量是哪种元素,在这题里减重的是CuO中的氧元素,它与H2结合成为H2O。根据方程式分析:设参加反应的CuO质量为y。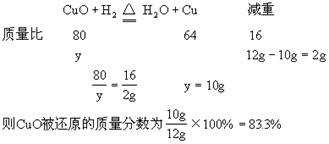
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点大全《物质结构和.. | ||