| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》考点强化练习(2017年押题版)(六)
参考答案:C 本题解析:A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ),错误;B.在0.1mol/L的NaHA溶液pH=4,c(H+)=10-4mol/L<0.1mol/L,所以则H2A为弱酸,错误;C.NaOH是强碱,醋酸是弱酸,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,由于酸过量,溶液显酸性,所以滴入石蕊呈红色,正确;D.在氨水中存在电离平衡:NH3?H2O 本题难度:一般 2、选择题 下列有关电解质溶液中粒子浓度关系正确的是 |
参考答案:A
本题解析:A.pH=1的NaHSO4溶液中根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(OH-)以及物料守恒c(Na+)=c(SO42-)可知c(H+)=c(SO42-)+c(OH-),A正确;B.碘化银的溶度积常数小于氯化银的,则含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)>c(I-),B错误;C.铵跟水解溶液显酸性,氢离子抑制铵跟的水解,则pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①=②>③,C错误;D.含等物质的量的NaHC2O4和Na2C2O4的溶液中根据物料守恒可知2c(Na+)=3[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)],D错误,答案选A。
考点:考查溶液中离子浓度大小比较
本题难度:一般
3、实验题 (1)(2分)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加 和 试剂(填化学式)
(2)(2分)乙同学为标定某醋酸溶液的准确浓度,用0.2000 mol·L—1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
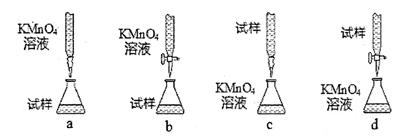
参考答案:8分
(1)(2分)Fe 稀硫酸 (2)(2分)0.2000mol/L
(3)b(2分)
滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色(2分)
本题解析:(1)FeSO4溶液易被氧化、易水解,故还需要加Fe和稀硫酸。
(2)实验序号3误差较大,舍去,用1、2、4的数据进行计算,c(CH3COOH)×0.02=[(20.05+20.00+19.95)÷3] ×0.2,解得c(CH3COOH)= 0.2000(mol/L)。
(3)①KMnO4溶液成放在酸性的滴定管中,故b正确。
②KMnO4溶液呈紫色,故判断滴定终点的依据是滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色。
考点:盐类的水解 中和滴定
点评:本题考查盐类的水解、中和滴定的知识,题目难度不大,本题注意根据硫酸亚铁和氢氧化亚铁的性质进行判断,注意把握实验的操作原理。
本题难度:一般
4、选择题 Al3+ + 3H2O Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
A.加热
B.加适量NaOH溶液
C.通入氯化氢气体
D.加入固体三氯化铝
参考答案:B
本题解析:水解吸热,加热促进水解,溶液的pH降低,A不正确;氢氧化钠能结合氢离子,降低氢离子的浓度,常见水解,B正确;C中增大氢离子的浓度,抑制水解,不正确;D中氧化铝不溶于水,对水解平衡几乎没有影响,不正确,答案选B。
考点:考查外界条件对水解平衡的影响
点评:该题是中等难度试题的考查,也是高考中的常见题型和考点。该题的关键是明确氯化铝的水解平衡特点,然后结合题意灵活运用勒夏特列原理即可,难度不大。
本题难度:一般
5、填空题 按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:
【小题1】硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
【小题2】稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol?L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL
【小题3】如何知道滴定到达终点?
【小题4】下列操作会导致测定结果偏低的是
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
【小题5】下列每种量器的数量不限,在上述实验中,必须使用的有
A.托盘天平
B.量筒
C.碱式滴定管
D.酸式滴定管
E. 容量瓶
【小题6】FeSO4的质量分数为
参考答案:
Ⅰ:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
Ⅱ:
【小题1】Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊 应加入少量H2SO4 【小题2】2Al3++3S2-+6H2O = 2Al(OH)3↓+3H2S↑
III:
【小题1】溶液由浅绿色变为紫红色,且半分钟后不变则达到滴定终
【小题2】C
【小题3】ABDE
【小题4】50%
本题解析:Ⅰ:考查反应热的计算和热化学方程式的书写。反应热就是断键吸收的能量和相差化学键放出的能量的差值。因此该反应的反应热为3×436kJ/mol+9466kJ/mol-2×3×3916kJ/mol=-926kJ/mol,因此反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1。
Ⅱ:硫酸铜属于强酸弱碱盐,在溶液中铜离子水解生成氢氧化铜和硫酸。因为水解是吸热的,加热促使水解平衡向正反应方向移动,生成氢氧化铜沉淀,所以溶液会产生混浊。要想不产生混浊,则必须抑制铜离子的水解,因为水解显酸性,所以可以加入少量硫酸以抑制水解。
III:考查基本实验操作和有关计算。
(1)因为高锰酸钾溶液是显紫红色的,当溶液中的亚铁离子被完全氧化生成铁离子后,如果再加一滴酸性高锰酸钾溶液,则溶液的颜色将显紫红色,据此可判断终点。
(2)选项A中相当于稀释了标准液,则消耗标准液的体积将偏大,测定结果偏高。锥形瓶在滴定实验中是不允许用标准液润洗的,B的操作是正确的。滴定管的刻度自上而下是逐渐增大的,滴定前平视,读数不影响。滴定到终点后俯视,则读数将偏低,因此消耗的标准液体积偏低,测定结果偏低。选项D中相当于把这一滴液体计算到标准液中,实验测定结果偏高。
(3)样品需要称量和溶解并配制溶液,所以A、B、D均需要。酸性高锰酸钾溶液具有强氧化性,需要放在酸式滴定管中,D需要。
(4)根据实验可知消耗高锰酸钾是10.00ml,根据方程式可知10.0ml待测液中硫酸亚铁的物质的量是5×0.01L×0.1mol/L=0.005mol。所以FeSO4的质量分数为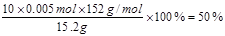 。
。
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《铁的氧化物.. | ||