微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业生产的生石灰中常混有二氧化硅和石灰石。现将该生石灰样品溶于过量的盐酸中。然后在不断搅拌(必要时可以加热)的情况下,向反应混合液中逐滴加入氢氧化钠溶液至过量,如果纵坐标表示固体难溶物的质量(m),横坐标表示所加入氢氧化钠溶液的体积(V),则下列图示正确的是( )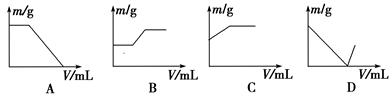
参考答案:B
本题解析:略
本题难度:简单
2、填空题 (12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是?。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是?。
(2)500℃、50MPa时,在容积为VL的容器中加入n?mol?N2、3n?mol?H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=?。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
物?质
| 燃烧热(kJ·mol-1)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
已知1mol?H2O(g)转变为1mol?H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式?。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式?。
参考答案:
(1)加压有利于平衡正向移动,提高原料气的转化率
增加反应速率,缩短达到平衡的时间?(2分)
(2)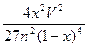 (4分)
(4分)
(3)CH4(g)+H2O(g)=CO(g)+3H2(g)?△H=+206.1 kJ·mol-1(4分)
(4)N2+6e-+8H+=2NH4+(2分)
本题解析:略
本题难度:简单
3、填空题 【化学-选修2化学与技术】(15分)
如图是现今常规生产发烟硫酸和硫酸的流程图:
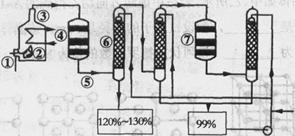
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是?.该处发生反应的方程式为??.为提高三氧化硫的产率,该处应采用?(填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是?.
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为:??.
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水?吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 ??.
参考答案:⑴ 接触室;2SO2+O2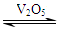 2SO3;等温过程
2SO3;等温过程
⑵该反应为可逆反应,二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境
⑶通过吸收塔⑥后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行。
⑷0.066
⑸在高温下,空气的氮气和氧气反应生成氮氧化物,有污染。低温下,氮氧化物被还原,生成N2,对环境保护有利
本题解析:(1)二氧化硫被氧化成三氧化硫是在接触室内进行的,该处发生反应的方程式为2SO2+O2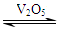 2SO3;为提高三氧化硫的产率,该处应采用等温过程。(2)该反应为可逆反应,在⑦处进行二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境;(3)⑤处气体混合物主要是氮气和三氧化硫,通过吸收塔⑥后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行,故不立即进入⑦;(4)1吨20%的发烟硫酸中含SO3的质量为0.2t,加水后可生成H2SO40.245t,即硫酸的总质量为1.245t,换算为98%的浓硫酸质量为1.245t÷98%=1.066t,故加入的水的质量为0.066t;(5)因为在高温下,空气的氮气和氧气反应生成氮氧化物,有污染;低温下,氮氧化物被还原,生成N2,对环境保护有利。
2SO3;为提高三氧化硫的产率,该处应采用等温过程。(2)该反应为可逆反应,在⑦处进行二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境;(3)⑤处气体混合物主要是氮气和三氧化硫,通过吸收塔⑥后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行,故不立即进入⑦;(4)1吨20%的发烟硫酸中含SO3的质量为0.2t,加水后可生成H2SO40.245t,即硫酸的总质量为1.245t,换算为98%的浓硫酸质量为1.245t÷98%=1.066t,故加入的水的质量为0.066t;(5)因为在高温下,空气的氮气和氧气反应生成氮氧化物,有污染;低温下,氮氧化物被还原,生成N2,对环境保护有利。
本题难度:一般
4、选择题 以下反应最符合绿色化学原子经济性要求的是
[? ]
①?乙烷与氯气制备一氯乙烷 ②?乙烯聚合为聚乙烯高分子材料
③?苯和硝酸反应制备硝基苯 ④?乙烯与氧气在银催化作用下生成环氧乙烷(C2H4O)
A.①?④?
B.①③?
C.②③?
D.②④
参考答案:D
本题解析:
本题难度:简单
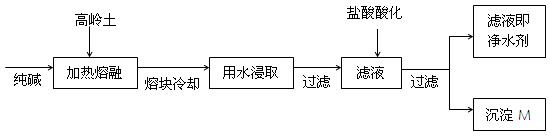
5、填空题 (8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
?
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式?、
?。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器?(填写编号)
A.铁坩埚
B.瓷坩埚
C.氧化铝坩埚
D.玻璃坩埚