微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在给定温度下发生下述反应:4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g)? ΔH="-3" 319 kJ/mol,又知反应后的固体残渣中含有4%的FeS2,试计算燃烧1kg这种硫铁矿时放出的热量。
2、填空题

(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______? __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________?__;
A.c(N2)=c(H2)="c" (NH3)? B.容器内压强保持不变?
C.υ(N2)=3υ(H2)? D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体? B.适当升高温度
C. 增大压强? D.选择高效的催化剂
3、填空题 .(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  ?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)?。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是?(填字母)。
a.容器内的密度保持不变?
b.容器内压强保持不变?
c.υ正(N2)=2υ逆(NH3)?
d.混合气体中c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
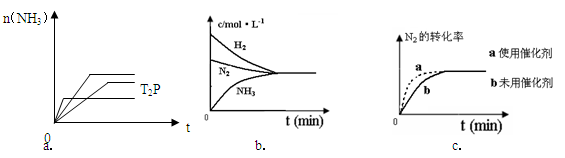
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
4、选择题 近年来受中东战乱以及世界金融危机的影响,世界油价波动变化很大,下列物质受石油价格影响最小的是(?)
A.聚乙烯
B.煤气
C.煤油
D.石蜡
5、填空题 工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按如下图所示流程制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。图中反应(Ⅰ)为氟磷灰石跟另一种原料反应,生成A、B、C三种物质,其中的产物C又跟氟磷灰石发生反应(Ⅱ),生成B和重过磷酸钙。
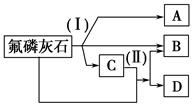
试写出两个反应的化学方程式:反应(Ⅰ)______________;反应(Ⅱ)___ _______
在生产中要特别注意_____________________________________________