微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1mol下述固体物质长期放置于空气中(不考虑潮解情况),最后质量增加的大小关系是
①氧化钠?②过氧化钠?③氢氧化钠?④亚硫酸钠.
A.①=③>②>④
B.①>②>④>③
C.③>①=②>④
D.④>③>②>①
参考答案:B
本题解析:分析:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;
③氢氧化钠与二氧化碳反应生成碳酸钠;
④亚硫酸钠和氧气反应生成硫酸钠.
解答:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;Na2O~Na2CO3;1molNa2O反应最后增加1molCO2的质量为 44g;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;Na2O2~Na2CO3,1molNa2O2反应最后增加1molCO的质量为28g;
③氢氧化钠与二氧化碳反应生成碳酸钠;NaOH~ Na2CO3,1molNaOH反应最后增重53-40=13g;
Na2CO3,1molNaOH反应最后增重53-40=13g;
④亚硫酸钠和氧气反应生成硫酸钠;Na2SO3~Na2SO4,1molNa2SO3反应后增重16g;
故增重为①>②>④>③;
故选B.
点评:本题考查钠及其化合物性质的应用,明确变化过程中的质量变化计算是解答本题的关键,题目难度中等.
本题难度:简单
2、选择题 将2.24LCO2,(标准状况)通人150mLlmol?L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列对反应后溶液的说法正确的是
A.n(CO32-)+n(HCO3-)=0.1mol
B.c(CO32-)略小于c(HCO3-)
C.c(Na+)=0.15mol?L-1
D.反应后只有一种产物
参考答案:B
本题解析:分析:n(CO2)=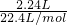 =0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
解答:n(CO2)=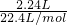 =0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,则
=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,则
A.溶液中存在CO32-、HCO3-、H2CO3,根据物料守恒,应有n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,故A错误;
B.由反应方程式可知,反应生成等物质的量的CO32-和HCO3-,CO32-水解程度大于HCO3-,且生成HCO3-,则c(CO32-)略小于c(HCO3-),故B正确;
C.根据Na元素守恒,由于溶液体积不变,则c(Na+)=c(NaOH)=1mol?L-1,故C错误;
D.由反应方程式可知,反应生成等物质的量的CO32-和HCO3-,为Na2CO3和NaHCO3的混合物,故D错误.
故选B.
点评:本题考查混合物反应的计算和判断,解答本题时,可根据反应物的物质的量关系快速写出反应的化学方程式,是计算的一种很好的方法,同学们可借鉴.
本题难度:一般
3、选择题 向100 mL 0.1mol·L—1硫酸铝铵[NH4Al(SO4)2] 溶液中逐滴滴入0.1 mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是
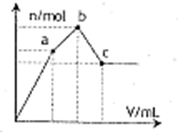
A.a点的溶液呈酸性
B.b点反应的离子方程式是:A13++2SO42—+2Ba2++3OH—=A1(OH)3↓+2BaSO4↓
C.c点加入Ba (OH)2溶液的体积为200 ml.
D.微热,除去溶液中的氨气后,C点溶液量中性
参考答案:A
本题解析:试题分析:在反应过程中,反应的方程式是2NH4Al(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+(NH4)2SO4,所以a点显酸性,A正确;如果继续加入氢氧化钡,则反应式是(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3·H2O,B错误;如果此时仍继续加入氢氧化钡,则氢氧化铝沉淀开始溶解,方程式是Al(OH)3+OH-=AlO2-+2H2O,则加入Ba (OH)2溶液的体积应该是250ml,C错误;微热出去NH3后,溶液为Ba(AlO2)2溶液,仍为碱性,D错误。答案选A。
考点:化学图像计算
点评:搞清楚图像中每一段发生的变化以及图像中数字的含义。
本题难度:困难
4、选择题 将足量的氯气通入下列溶液中,溶质阴、阳离子的数目都明显改变的是
A.AgNO3
B.FeBr2
C.NaOH
D.Na2CO3
参考答案:B
本题解析:
本题难度:困难
5、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO、Na+
B.c(Fe3+)=0.1?mol?L-1的溶液中:K+、SO、SCN-
C.加入Al能放出H2的溶液中:Mg2+、Cl-、K+
D.酸性溶液中:Al3+、Mg2+、Cl-、SO42-
参考答案:D
本题解析:分析:A.pH=1的溶液,显酸性,离子之间发生氧化还原反应;
B.离子之间结合生成络离子;
C.加入Al能放出H2的溶液,为酸或强碱溶液;
D.酸性溶液中该组离子之间不反应.
解答:A.pH=1的溶液,显酸性,H+、Fe2+、NO3-离子之间发生氧化还原反应,不能共存,故A错误;
B.Fe3+、SCN-离子之间结合生成络离子,则不能共存,故B错误;
C.加入Al能放出H2的溶液,为酸或强碱溶液,碱溶液中Mg2+、OH-结合生成沉淀,不能共存,故C错误;
D.酸性溶液中该组离子之间不反应,能大量共存,故D正确;
故选D.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应是解答的关键,注意选项A中的氧化还原为解答的难点,题目难度不大.
本题难度:困难