微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
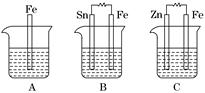
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
参考答案:Ⅰ.铁丝表面生成一层红棕色的铁锈 铁发生吸氧腐蚀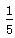 空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
Ⅱ.(1)Fe+2H+===Fe2++H2↑
(2)2H++2e-===H2↑ 增大
(3)Zn Zn+2H+===Zn2++H2↑ B>A>C
本题解析:该装置中铁丝发生吸氧腐蚀生成铁锈(Fe2O3·nH2O),经过足够长的时间后,试管内空气中的氧气完全被吸收,导致压强减小,液面上升,上升高度与空气中所含氧气的体积分数相同,约占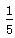 .
.
(Ⅱ)A中Fe失电子,氢离子得到电子被还原为氢气;B中形成原电池,Sn为正极,为电子流入的一极,氢离子得电子被还原产生氢气,由于消耗了溶液中的氢离子,所以pH增大;C中锌作负极被氧化,Zn-2e-===Zn2+,正极:2H++2e-===H2↑,总反应为Zn+2H+===Zn2++H2↑,C中Fe被保护,B中能加快腐蚀.
点评:本题考查铁的腐蚀相关的电化学知识,难度不大,侧重考查学生实验观察能力及分析问题能力,解题的关键是要读懂图,了解问题的实质。
本题难度:一般
2、选择题 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是(?)
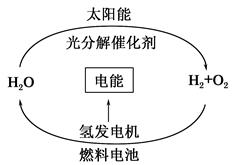
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O?2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
参考答案:C
本题解析:氢氧燃料电池的负极通入H2,发生氧化反应;正极通入O2,发生还原反应,故B正确。原电池都是将化学能转化为电能的装置,故A正确。推广氢能的关键是寻找合适的催化剂,利用太阳能分解水。
本题难度:一般
3、选择题 已知空气、锌电池的电极反应为:锌片Zn+2OH--2e-=ZnO+H2O,石墨1/2O2十H2O+2e-=2OH-,由此判断锌片是
A.正极被还原
B.正极被氧化
C.负极被还原
D.负极被氧化
参考答案:D
本题解析:
本题难度:简单
4、选择题 将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中 一段时间,以下叙述正确的是
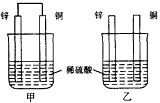
[? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙快
参考答案:CD
本题解析:
本题难度:一般
5、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
[? ]
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2↑
B.来源:91考试网 91ExaM.org氢氧燃料电池的负极反应式:O2+2H2O+4e-==4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-==Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-==Fe2+
参考答案:A
本题解析:
本题难度:一般