微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)某报刊曾报道下面一段新闻“某日凌晨,一辆载有浓硫酸的罐车在某境内侧翻。从车中流出的硫酸使路边杂草等被腐蚀成黑色,上面泛起黑色的泡沫,空气中到处弥漫着刺鼻的气味。”请用化 学知识解释下列问题:
⑴ “路边杂草被腐蚀成黑色”其原因是?
⑵浓硫酸为不挥发性强酸,为什么说“到处弥漫着刺鼻的气味”
?。
⑶该运载硫酸的车罐可能是用?制造的。
⑷写出两种鉴别浓硫酸和稀硫酸的简单方法
?
?
参考答案:(7分)
⑴浓硫酸使草碳化(1分)
⑵碳化后的碳与浓硫酸反应生成SO2(1分)
⑶铁或铝(1分)
⑷方法一:分别取少量样品于两只试管中,分别加入铁片或铝片,有气体生成的是稀硫酸,没有明显现象的是浓硫酸(2分)
方法二:分别取少量样品于两只试管中,分别加入CuSO4·5H2O 晶体,晶体溶解溶液呈蓝色的是稀硫酸,固体由蓝色变成白色的是浓硫酸(2分)
(其他合理答案也可以)
本题解析:略
本题难度:一般
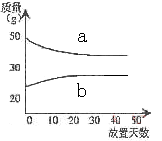
2、选择题 将浓硫酸和稀硫酸在实验室中分别敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是?(?)。
A.a挥发、b吸水
B.a升华、b冷凝
C.a蒸发、b潮解
D.a冷凝、b吸水
参考答案:A
本题解析:浓硫酸具有吸水性,所以溶液的质量增加,即b表示浓硫酸。稀硫酸具有挥发性,所以溶液的质量减少,则a表示稀硫酸,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对浓硫酸和稀硫酸物理性质的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
3、选择题 Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是
A.氯化物
B.硫酸盐
C.硝酸盐
D.碳酸盐
参考答案:C
本题解析:由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知为硝酸盐。
本题难度:一般
4、实验题 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
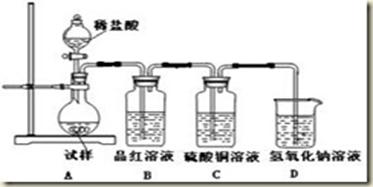
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为________________;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为__________;此时在B、C两装置中可能观察到的现象为___________或___________。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为___________。检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取____________措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是______(填“甲”或“乙”)。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式____________。
参考答案:(1)先逐渐增大,后逐渐减小 (2分)
(2)2S2-+SO32-+6H+=3S↓+3H2O(2分);
B中品红溶液褪色,C中无明显变化(1分);B中无明显变化,C中产生黑色沉淀 (1分)
(说明:在同一空格中答“B中品红溶液褪色,C中产生黑色沉淀”不得分)
(3)SO42-(2分)搅拌(或加热)(2分);乙(2分);
(4)4Na2SO3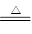 Na2S+3Na2SO4(2分)
Na2S+3Na2SO4(2分)
本题解析:(1)温度低于600℃,Na2SO3不分解,先反应生成NaHSO3,全部转化为NaHSO3后,再继续反应生成SO2和H2O,所以HSO3-的物质的量浓度变化趋势为先逐渐增大,后逐渐减小;(2)如果加热温度为700℃,Na2SO3分解,得到Na2S和Na2SO4,加盐酸反应2S2-+SO32-+6H+=3S↓+3H2O,还有大量气泡可能是H2S或SO2,所以现象为B中品红溶液褪色,C中无明显变化或者B中无明显变化,C中产生黑色沉淀。(3)分解产物中有Na2SO4,SO42-的鉴定甲方案加硝酸,把SO32-氧化为SO42-,不能证明它的存在,甲错误,乙正确。
本题难度:一般
5、计算题 接触法制硫酸,最后的产品是质量分数为98%的硫酸或20%的发烟硫酸(H2SO4和SO3的混合物,其中含20%的SO3)。
小题1:若98%的硫到可表示为SO3·aH2O,20%的发烟硫酸可表示为SO3·bH2O,
则a,b的值(a、b可用分数表示)分别是:a=_________,b=____________;
小题2:用 分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是:
分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是: =______
=______ ,
, =______
=______ ;
;
小题3:若工厂同时生产上述两种硫酸,则两种产品的质量比x( ,
, 的硫酸的质量,
的硫酸的质量, 的发烟硫酸的质量)与
的发烟硫酸的质量)与 用量之比的关系是:
用量之比的关系是: ___________x;
___________x;
小题4:实际生产时,总 的物质的量一定,x随市场需求而有改变,则用水总量
的物质的量一定,x随市场需求而有改变,则用水总量 、x、
、x、 的关系式是_________________。
的关系式是_________________。
参考答案:
小题1: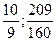
小题2: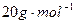 ;
;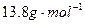
小题3: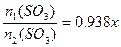
小题4: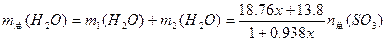
本题解析:
小题1:98% 可表示为
可表示为 ,即此
,即此 中每含
中每含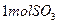 ,必含
,必含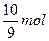 水,其质量为
水,其质量为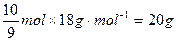 ,同理,
,同理,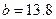
小题2: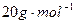 ;
;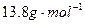
小题3: 组成得下列关系:
组成得下列关系:
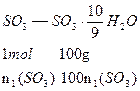
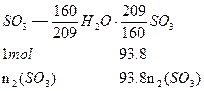
依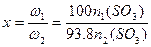 ,得
,得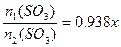
小题4: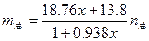
解析:由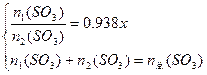
得: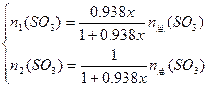
由(2)得: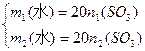
由此,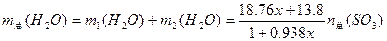
本题难度:简单