微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
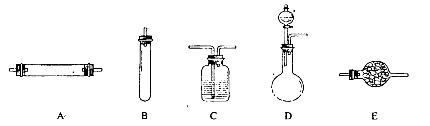
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
参考答案:(1)D; CaO和水反应,减少了溶剂;CaO和水反应放热,降低了氨气的溶解度。
(2)E?碱石灰
(3)NaNO2+NH4Cl NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)Cu和CuO可以循环使用,节省试剂;避免使用有毒物质NaNO2而造成污染,
(5)方法二制的氮气含有稀有气体的密度比氮气密度大,所以导致氮气密度偏大
本题解析:(1)用CaO和浓氨水反应,应选固液常温型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为CaO+NH3?H2O=NH3↑+Ca(OH)2,因为氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程中,生石灰的两个作用是:一方面消耗氨水溶液中的水,另一方面放出的热量促使氨水挥发、分解而得到氨气;
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,反应前后元素的种类不变,因此生成物还有氯化钠和水,因此反应的方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)从题中信息可知,NH3和CuO生成Cu和N2而空气和Cu生成CuO,故Cu和CuO可以循环使用,方法三使用有毒的亚硝酸钠,方法一和二避免使用有毒物质而造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染).
(5)将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大5‰左右;
本题难度:一般
2、填空题 (11分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的氧化物,实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:

(1)写出Cu2(OH)2CO3在水中的沉淀溶解平衡方程式?,溶液A的金属离子有Cu2+、Fe2+、Fe3+。检验溶液A中Fe3+的最佳试剂为?,试剂①为?(从下列所给字母中选填,下同)
a.KMnO4? b.KI ? c.H2O2? d.KSCN
(2)写出溶液A到溶液B的离子方程式?_________?
(3)试剂②是CuO,还可以是下列的?,作用是?。
a.CuCl2? b.CuCO3? c.Cu(OH)2? d.CuSO4?
(4)沉淀C的化学式为?。
参考答案:(1)Cu2(OH)2CO3(s) 2Cu2+(aq)+ 2OH-(aq)+ CO32-(aq)(2分)
2Cu2+(aq)+ 2OH-(aq)+ CO32-(aq)(2分)
d (1分)c?(2)2Fe2++H2O2+2H+= 2Fe2++2H2O(2分)?
消耗溶液中的H+调节pH,使Fe3+沉淀。(2分)(3)bc(2分)(4)Fe(OH)3
本题解析:Cu2(OH)2CO3(s) 2Cu2+(aq)+ 2OH-(aq)+ CO32-
2Cu2+(aq)+ 2OH-(aq)+ CO32-
2Fe2++H2O2+2H+= 2Fe2++2H2O消耗溶液中的H+调节pH,使Fe3+沉淀。
本题难度:一般
3、选择题 实验桌上放有托盘天平、研钵、三脚架、泥三角、蒸发皿、坩埚、干燥器、酒精灯、火柴、烧杯、量筒100 mL、容量瓶、药匙、玻璃棒、石棉网、胶头滴管、坩埚钳。从缺乏仪器和用具的角度来看,不能进行的实验项目是
A.配制0.1 mol·L-1 100 mL的CuSO4溶液
B.蒸发
C.测定硫酸铜晶体中结晶水的含量
D.萃取、分液
参考答案:D
本题解析:分液、萃取要使用分液漏斗。
本题难度:简单
4、选择题 某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过如图中洗气瓶后气体体积减小,通过干燥管后气体呈红棕色, 则下列推断正确的是
则下列推断正确的是
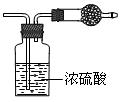
A.干燥管内固体为碱石灰
B.原气体中一定有NO和O2
C.原气体中一定有NH3、NO和CO2
D.原气体中一定没有HCl、Br2和CO2
参考答案:C
本题解析:略
本题难度:一般
5、选择题 实验室欲快速制取氢气,应采取的措施是
A.用纯锌和稀硫酸反应
B.用含铜等的粗锌和稀硫酸反应
C.用纯锌和浓硫酸反应
D.用含铜等的粗锌和稀硝酸反应
参考答案:B
本题解析:A 错误,纯锌和稀硫酸反应较慢。
B 正确,含铜等的粗锌和稀硫酸时,会形成铜锌原电池,加快反应速率
C 错误,纯锌和浓硫酸反应不生成氢气,产生的是二氧化硫气体。
D 错误,含铜等的粗锌和稀硝酸反应也不生成氢气,生成的是二氧化氮气体
本题难度:一般