| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《水的电离平衡》答题技巧(2017年最新版)(六)
参考答案:(12分,每空2分) 本题解析:略 本题难度:困难 2、选择题 室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是 |
参考答案:C
本题解析:A.NaOH、HA是一元碱、一元酸,当二者恰好完全反应时二者的物质的量相等,体积也相等,说明它们的浓度相等,该一元酸溶液浓度也相等,为0.10mol/L,正确;B.向弱酸溶液中加入强碱NaOH,发生中和反应产生盐,自由移动的离子浓度增大,溶液的导电性增强;当加入至酸完全反应时,自由移动离子进一步增多,离子浓度增大,溶液的导电性增强;后在加入NaOH,就相当与向盐NaA溶液中加入NaOH溶液。溶液中自由移动离子浓度增大,所以溶液的导电性比b点还强。故a、b、c点的水溶液导电性依次增强,正确;C.在未滴加NaOH溶液时,溶液的pH="2," c(H+)=10-2mol/L,NaOH是强碱,完全电离,当NaOH溶液滴入20ml时,恰好与酸HA完全反应,此时溶液的pH>7,说明得到的是强碱强弱酸盐,因此HA是弱酸,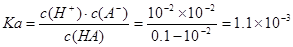 ,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
考点:考查电解质强弱的判断、物质浓度的计算及对水电离平衡的移动的影响的知识。
本题难度:困难
3、填空题 写出下列物质在水溶液中的电离方程式
氯化铜______
硫酸铁______
碳酸氢钠______
硫酸氢钠______.
参考答案:氯化铜是强电解质,电离时电离出自由移动的铜离子和氯离子,CuCl2=Cu2++2Cl-,
硫酸铁强电解质,电离时电离出自由移动的铁离子和硫酸根离子,Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
本题解析:
本题难度:简单
4、实验题 某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。 就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____ _______。
(2)判断到达滴定终点的实验现象是:_________ ________。
(3)操作步骤B的意义: 。
(4)下面a~e是中学化学实验中常见的几种定量仪器:a 量筒;b 容量瓶;c 滴定管;d 托盘天平;e 温度计
①.其中标示出仪器使用温度的是________________(填写编号);
②.由于错误操作,使得到的数据比正确数据偏小的是_____________(填写编号);
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面度数
C.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
D.用待测溶液润洗锥形瓶
参考答案:(1)BDCEAF; (2)溶液由无色变为粉红色,且半分钟内不褪
(3)防止标准液浓度变稀 (4)A,B,C A,B
本题解析:(1)根据酸碱中和滴定原理以及实验操作注意事项可知,正确的操作步骤顺序是BDCEAF。
(2)碱液使酚酞显红色,酸使酚酞显无色,则判断到达滴定终点的实验现象是溶液由无色变为粉红色,且半分钟内不褪。
(3)标准液润洗滴定管的目的是防止标准液浓度变稀,造成试验误差。
(4)①其中标示出仪器使用温度的是量筒、量瓶、滴定管,答案选abc。
②用量筒量取一定量液体时,俯视液面读数,则读数偏小;中和滴定达终点时俯视滴定管内液面度数,则读数偏小;使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度,则容量瓶中溶液的体积偏小,浓度偏高;用待测溶液润洗锥形瓶,则消耗标准液的体积增加,浓度偏高,答案选AB。
考点:考查酸碱中和滴定实验的基本操作以及误差分析
点评:该题是基础性试题的考查,侧重对学生基本实验操作能力的培养。有利于培养学生规范严谨的实验设计能力,有利于调动学生的学习兴趣,激发学生的学习积极性。该题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
5、选择题 下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
① 溶液 ②
溶液 ② 溶液
溶液
③ 溶液 ④
溶液 ④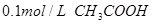 溶液
溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:酸中C(H+)越大,溶液的pH就越小。①是一元强酸,②是二元强酸,④是一元弱酸,③是一元强碱。当酸的浓度相等时,二元强酸的氢离子的浓度大于一元强酸的,一元强酸的大于一元弱酸的,碱中的氢离子浓度最小,因此C(H+)由大到小的顺序是②①④③ ,所以pH由小到大顺序排列②① ④ ③,选项是B。
考点:考查溶液中的pH 的大小排列顺序的知识。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点整理《物质的组成.. | ||