微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是(?)
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)
参考答案:BC
本题解析:略
本题难度:一般
2、选择题 常温下,向20.00 mL 0.1000 mol·L-1CH3COONa溶液中逐滴加入0.1000 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是
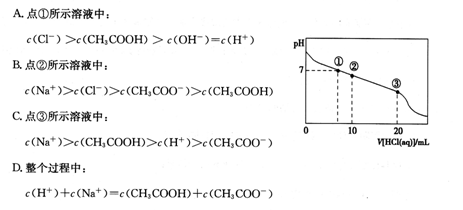
参考答案:C
本题解析:A。在①点溶液的pH=7,c(H+)=c(OH-),CH3COONa+HCl=CH3COOH+NaCl,c(CH3COOH)= c(NaCl)=c(Cl-),盐的电离远大于弱电解质的电离。因此c(Cl-)=c(CH3COOH) >c(H+)=c(OH-) .错误。B.在②所示的溶液中,发生反应CH3COONa+HCl=CH3COOH+NaCl,得到的溶液中n(NaCl)= n(CH3COOH)= n(CH3COONa)。.因为此溶液显酸性,所以CH3COOH的电离作用大于CH3COO-的水解作用。因此,c(Na+)>c(CH3COO-)> c(Cl-)> c(CH3COOH).错误。C.在点③所示的溶液中,恰好完全发生反应CH3COONa + HCl=CH3COOH+NaCl,得到的是CH3COOH与NaCl的混合溶液,由于醋酸是弱酸,发生电离作用,所以c(Na+)>c(CH3COOH),在溶液中除了存在酸的电离,还存在水的电离作用,因此c(H+)> c(CH3COO-),但是酸或水的电离作用是微弱的,所以c(CH3COOH) > c(H+)。所以在溶液中的离子的浓度关系为:c(Na+)>c(CH3COOH) > c(H+)> c(CH3COO-)。正确。D.在整个过程中,根据电荷守恒可得c(H+)+ c(Na+)= c(Cl-)+c(CH3CO-),根据物料守恒可得c(Na+)= c(CH3CO-)+ c(CH3COOH)。错误。
本题难度:一般
3、选择题 弱电解质的电离程度可用电离度(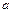 )表示:
)表示: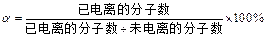 ,现有pH均为4的HCl和
,现有pH均为4的HCl和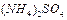 溶液,则两种溶液中H2O的电离度之比为( )
溶液,则两种溶液中H2O的电离度之比为( )
A.1:2
B.2:5
C.1:106
D.106:1
参考答案:C
本题解析:略
本题难度:简单
4、选择题 一定温度下,向10ml?0.1mol/L的醋酸溶液和10ml?0.1mol/L的盐酸中投入足量相同大小的锌粒,下列说法正确的是( )
A.反应起始速率相等
B.生成的H2质量相等
C.原溶液的pH相等
D.盐酸生成的H2多
参考答案:B
本题解析:
本题难度:一般
5、填空题 现有浓度均为0.1mol?L-1的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸氢铵.⑦氨水,请回答下列问题:
(1)①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______.
(2)④.⑤.⑥.⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)______.
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是______.
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)______25℃.
参考答案:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,H2SO4中氢离子浓度是0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NaCl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,溶液中氢离子和氢氧根离子浓度都较小,结合物料守恒得,溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,t℃时,Kw=1×10-13>10-14,所以t℃>25℃,故答案为:>.
本题解析:
本题难度:一般