微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用12mL0.8mol/L的FeSO4溶液,恰好还原4.8×10-3mol[RO(OH)2]+,则R元素的最终价态为( )
A.+2价
B.+3价
C.+4价
D.+5价
参考答案:[RO(OH)2]+ 中R的化合价是+5价,该反应中,亚铁离子失电子生成铁离子,R元素得电子发生还原反应,
设R元素的最终价态为x,
根据转移电子守恒得:0.8mol/L×0.012L×(3-2)=4.8×10-3mol×(5-x),
0.0096mol=4.8×10-3mol×(5-x),
x=+3,
故选B.
本题解析:
本题难度:一般
2、选择题 电解100 mL含c(H+) =0.30 mol/L的下列溶液,当电路中通过0. 04mol电子时,理论上析出金属质量最大的是
[? ]
A.0. 10 mol/L Ag+
B.0. 20 mol/L 2n2+
C.0.20 mol/L Cu2+
D.0. 20 mol/L Pb2+
参考答案:C
本题解析:
本题难度:一般
3、选择题 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成lmo1Cr2O72-?所需PbO2的物质的量为
A.3.0mo1
B.1.5mo1
C.1.0mo1
D.0.75mo1
参考答案:A
本题解析:分析:PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,化合价变化为: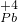 O2→
O2→ 2+,
2+,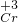 3+→
3+→ 2O72-,根据氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
2O72-,根据氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
解答:PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,化合价变化为: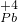 O2→
O2→ 2+,
2+,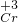 3+→
3+→ 2O72-,
2O72-,
氧化还原反应中氧化剂与还原剂得失电子数目相等,表现为化合价升降总数相等,设所需PbO2的物质的量为x,则
1mol×2×(6-3)=x×(4-2),
x=3.0mol,
故选A.
点评:本题考查氧化还原反应,题目难度不大,注意根据化合价的变化结合氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
本题难度:困难
4、选择题 航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃烧,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4(s)=N2(g)?+?4H2O(g)?+?Cl2(g)?+?2O2(g)?△H<0下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵中只起氧化剂的作用
参考答案:D
本题解析:反应物高氯酸铵中氮元素的化合价升高,氯元素的化合价降低,所以该物质既是氧化剂,又是还原剂,选项D不正确,其余都是正确的,答案选D。
本题难度:一般
5、简答题 已知Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,若有0.2molCu反应掉,则生成SO2的体积为:______(标况下),有______mol?H2SO4发生还原反应.
参考答案:Cu+2H2SO4(浓)?△?.?CuSO4+2H2O+SO2↑? 被还原的H2SO4
? 1?1? 1?
? 0.2mol? n(SO2)? n(H2SO4)被还原
n(SO2)=0.2mol,V(SO2)=0.2mol×22.4L/mol=4.48L,
n(H2SO4)被还原=0.2mol,
故答案为:4.48L;?0.2.
本题解析:
本题难度:一般