微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铜棒和铝棒用导线连接后插入浓硝酸溶液中,下列叙述中正确的是( )
A.该装置能形成原电池,其中铝是负极
B.该装置能形成原电池,其中铜是负极
C.该装置不能形成原电池
D.以上说法均不正确
参考答案:常温下,铁、铝能与浓硫酸或浓硝酸发生钝化现象而阻止铝与浓硝酸发生反应,铜与浓硝酸能自发的发生氧化还原反应,铜失电子发生氧化反应作负极,铝作正极,所以该装置能形成原电池,
故选B.
本题解析:
本题难度:简单
2、简答题 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2mol氢气完全燃烧生成水蒸气,则放出的热量______?(填“>”、“<”或“=”)570kJ
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极均由多孔的碳块组成.该电池的正极为:______(填A或B).若该电池工作时增加了1mol?H2O,电
路中转移电子的物质的量为______?mol.
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:______.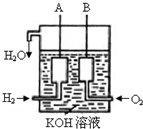
参考答案:(1)1mol氢气完全燃烧生成液态水放出285kJ的热量,所以2mol氢气完全燃烧生成液态水放出570kJ的热量,但是液态水变为气态水时,要吸收一部分热量,所以2mol氢气完全燃烧生成水蒸气,则放出的热量<570kJ,故答案为:<;
(2)燃料电池中,正极上通的一定是氧气,所以B极是正极,根据电池反应:2H2+O2?点燃?.?2H2O,当生成2mol水时,转移电子为4mol,所以若该电池工作时增加了1mol?H2O,电路中转移电子的物质的量为2mol,故答案为:B;2;
(3)燃料电池的负极一定是燃料失电子的过程,在碱性环境下,甲烷失电子的电极反应为:CH4+8e-+10OH-=CO32-+7H2O,故答案为:CH4+8e-+10OH-=CO32-+7H2O.
本题解析:
本题难度:一般
3、选择题 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶) (? )
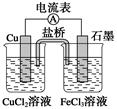
A.该原电池的总反应式为2Fe3++Cu=2Fe2++Cu2+
B.该电池工作时,Cu2+在电极上得到电子,发生还原反应
C.该电池工作时,氯化铜溶液中氯离子浓度增大
D.电池工作过程中,电子由铜电极经过电流表流向石墨电极
参考答案:B
本题解析:A、根据原电池的结构示意图可知该原电池的总反应式为2Fe3++Cu=2Fe2++Cu2+,正确;B、由电池反应分析知Fe3+在电极上得到电子,发生还原反应,错误;C、该电池工作时Cu—2e—=Cu2+,Cu2+进入氯化铜溶液中,盐桥中氯离子进入氯化铜溶液中而使氯离子浓度增大,正确;D、铜电极作负极,石墨电极做正极,电子由正极经过电流表流向负极,正确。
本题难度:一般
4、选择题 以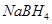 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是

A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:
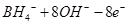 =
=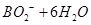
D.电路中通过6.02×1022个电子时,理论上消耗 mol
mol
参考答案:D
本题解析:B、H2O2具有强氧化性,易得电子,所以电极b为原电池的正极,正确;A、电池内部阳离子向正极移动,所以该电池工作时Na+由a极区移向b极区,正确;C、BH4-在负极上失去电子,生成BO2-,配平可得电极方程式:BH4-+8OH?—8e?= BO2-+6H2O,正确;D、根据化合价的变化可得H2O2与转移电子的对应关系:H2O2 ~2e?,所以电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol。
本题难度:简单
5、填空题 如图所示2套实验装置,分别回答下列问题.
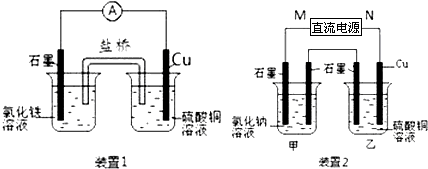
(1)装置1中的Cu是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(2)装置2中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象.
①电源的M端为______极,甲烧杯右边石墨电极附近首先变红的原因是______.
②乙烧杯中电解反应的离子方程式为______.
③若装置甲阴、阳两极各产生112mL气体(标准状况),则装置乙所得溶液的pH为______(忽略反应前后溶液的体积变化).
参考答案:(1)装置1为原电池,铜为负极,被氧化,石墨正极,电池反应为2Fe3++Cu═2Fe2++Cu2+,故答案为:负;2Fe3++Cu═2Fe2++Cu2+;
(2)向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极生成OH-,应为电解池的阴极,则M为电源的正极,N为电源的负极,甲为电解食盐水装置,乙为电解硫酸铜装置,则
①由以上分析可知M为正极,阴极上分别发生H2O?H++OH-、2H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性,
故答案为:正;H2O?H++OH-,H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性;
②乙为电解硫酸铜溶液,阳极生成氧气,阴极生成铜,电解的方程式为2Cu2++2H2O电解.2Cu+O2↑+4H+,故答案为:2Cu2++2H2O电解.2Cu+O2↑+4H+;
③若装置甲阴、阳两极各产生112mL气体(标准状况),则n(H2)=0.112L22.4L/mol=0.005mol,由2H++2e-═H2↑可知转移0.01mol电子,由2Cu2++2H2O电解.2Cu+O2↑+4H+可知,生成0.01molH+,则c(H+)=0.01mol0.1L=0.1mol/L,pH=1,
故答案为:1.
本题解析:
本题难度:一般