微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量的变化趋势,错误的是
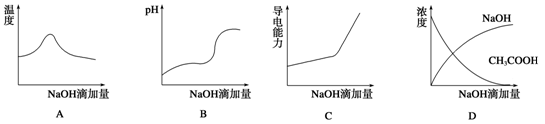
参考答案:D
本题解析:氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确;B.醋酸中滴加氢氧化钠酸性减弱pH增大,当酸碱恰好发生中和时,pH突变,醋酸完全反应后,溶液碱性逐渐增强,B正确;C.醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加,C正确;D.醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,当醋酸剩余时,氢氧化钠物质的量0,醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误,选D。
考点:考查弱电解质的电离。
本题难度:一般
2、填空题 (8分)水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
参考答案:(8分)(1)10-14 10-12各1分
(2)2:9 2分
(3)0.004 2分
(4)1:10:10 :10
:10 2分
2分
本题解析:略
本题难度:简单
3、填空题 (1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别
| 一元酸
| NaOH
| pH
|
甲
| c(HX)=0.1mol/L
| c(NaOH)=0.1mol/L
| pH=9
|
乙
| c(HY)=c1mol/L
| c(NaOH)=0.1mol/L
| pH=7
|
①甲组实验的混合溶液中离子浓度由大到小顺序为 。由水电离出的c(OHˉ)= mol/L。
②乙组实验中HY为强酸,则HY溶液的c1 (填“<”、“=”或“>”)0.1。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n(NO)/n(CO)比例变化情况如下图。
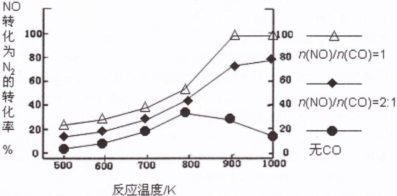
①为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 。
②用CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO2发生反应的化学方程式为 。
(3)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) △H
CH3OH(g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度
| 523K
| 573K
| 623K
|
平衡常数(K)
| 2.041
| 0.270
| 0.012
|
①由表中数据判断△H 0(填“<”、“=”或“>”)。
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为 。
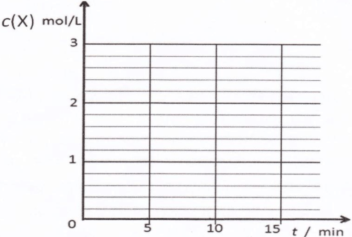
③请在下列坐标中画出②中求得该温度下CO、H2和CH3OH的浓度随时间变化的曲线,并进行适当的标注。
参考答案:(17分)(1)①c(Na+)>c(Xˉ)>c(OHˉ)>c(H+)(2分) 10ˉ5(2分) ②=(1分)
(2)①900K(1分,不写单位或900℃不给分) n(NO)/n(CO)=1(1分,只写1也给分)
②CH4+2NO2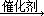 CO2+N2+2H2O(2分,化学式错不给分,系数错扣1分,不写条件不扣分,用等号不扣分)
CO2+N2+2H2O(2分,化学式错不给分,系数错扣1分,不写条件不扣分,用等号不扣分)
(3)①<(2分) ②523K(2分,不写单位或523℃不给分)
③
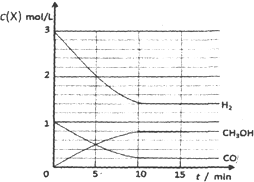
(3分,每条曲线1分,标注错或坐标数值错不给分)
本题解析:(1)①HX与NaOH恰好完全中和,所得NaX溶液pH=9,说明NaX是强碱弱酸盐,HX是弱酸;由于电离程度NaX>H2O,前者电离出的Xˉ部分水解,则混合溶液中c(Na+)>c(Xˉ)>c(OHˉ)>c(H+);H2O OHˉ+H+,NaX能促进水的电离平衡右移,则水电离出的c(OHˉ)>10ˉ7mol/L,由pH=9可知溶液中c(H+)=10ˉ9mol/L<10ˉ7mol/L,由水的离子积可知,溶液中的c(OHˉ)=Kw/ c(H+)=10ˉ5mol/L>10ˉ7mol/L,所以混合溶液中水电离出的c(OHˉ)=10ˉ5mol/L;②HY是强酸,则NaY是强酸强碱盐,混合溶液pH=7,说明HY与NaOH恰好完全中和,则c(HY)=c(NaOH)=0.1mol/L,所以c1=0.1;(2)①读图可知,相同温度下,n(NO)/n(CO)越大,NO的转化率越小;投料比最小时,温度越高,NO转化率越大,但是 900K时NO转化率已经接近100%,再升高温度,需要消耗更多的能量,NO转化率却增加不大,得不偿失,因此最佳温度和投料比分别为900K、n(NO)/n(CO)=1;②根据题意可知反应产物为CO2、N2、H2O,假设甲烷的系数为1,根据碳、氢、氧、氮原子个数守恒配平可得反应式:CH4+2NO2
OHˉ+H+,NaX能促进水的电离平衡右移,则水电离出的c(OHˉ)>10ˉ7mol/L,由pH=9可知溶液中c(H+)=10ˉ9mol/L<10ˉ7mol/L,由水的离子积可知,溶液中的c(OHˉ)=Kw/ c(H+)=10ˉ5mol/L>10ˉ7mol/L,所以混合溶液中水电离出的c(OHˉ)=10ˉ5mol/L;②HY是强酸,则NaY是强酸强碱盐,混合溶液pH=7,说明HY与NaOH恰好完全中和,则c(HY)=c(NaOH)=0.1mol/L,所以c1=0.1;(2)①读图可知,相同温度下,n(NO)/n(CO)越大,NO的转化率越小;投料比最小时,温度越高,NO转化率越大,但是 900K时NO转化率已经接近100%,再升高温度,需要消耗更多的能量,NO转化率却增加不大,得不偿失,因此最佳温度和投料比分别为900K、n(NO)/n(CO)=1;②根据题意可知反应产物为CO2、N2、H2O,假设甲烷的系数为1,根据碳、氢、氧、氮原子个数守恒配平可得反应式:CH4+2NO2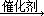 CO2+N2+2H2O;(3)①根据表中信息推断,升高温度平衡常数减小,前者说明平衡向吸热方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是△H<0的放热反应;②根据各组分的变化浓度之比等于系数之比,可求平衡浓度:
CO2+N2+2H2O;(3)①根据表中信息推断,升高温度平衡常数减小,前者说明平衡向吸热方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是△H<0的放热反应;②根据各组分的变化浓度之比等于系数之比,可求平衡浓度:
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始浓度/mol?Lˉ1 1 3 0
变化浓度/mol?Lˉ1 0.8 1.6 0.8
平衡浓度/mol?Lˉ1 0 .2 1.4 0.8
K=c(CH3OH)/[c(CO)?c2(H2)]=" 0.8/[0" .2×1.42]=2.041
与表中数据对比可知,平衡时温度为523K。
③画图要点:a、起点时,t=0,c(CO)=1mol/L,c(H2)=3mol/L,c(CH3OH)=0;b、平衡点或拐点时,t=10min,c(CO)=0.2mol/L,c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L;c、起点至平衡点或拐点时,反应物浓度逐渐减小,生成物浓度逐渐增大,且各组分的变化浓度之比等于化学方程式中相应的系数之比;平衡点或拐点之后,各组分的浓度保持不变。
考点:考查化学反应原理,涉及酸和碱混合溶液中离子浓度大小关系、盐类水解、水的电离、化学平衡、化学方程式等考点。
本题难度:困难
4、选择题 已知某温度下水的离子积KW=3.4×10-15.取该温度下浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1
B.0.017mol·L-1
C.0.05mol·L-1
D.0.50mol·L-1