微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关下列两种溶液的说法中,正确的是( )
溶液①:0.2mo1?L-1?CH3COONa溶液;
溶液②:0.1mo1?L-1H2SO4溶液.
A.相同温度下,溶液中水的电离程度:溶液①<溶液②
B.加水稀释溶液①,溶液中
c(CH3COOH)?c(OH-)
c(CH3COO-)
|
变大
C.等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO42-)=c(Na+)
D.25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO42-)
2、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
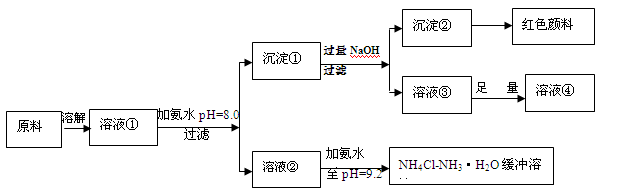
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
3、选择题 25℃,水的电离达到平衡:H2O 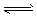 H++OH- ,下列叙述正确的是?
H++OH- ,下列叙述正确的是?
[? ]
A.向水中加入稀醋酸,平衡逆向移动,c(H+)降低
B.向水中加入少量固体碳酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
4、填空题 (12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
5、实验题 (11分)(1)下图分别是温度计、量筒、滴定管的一部分,
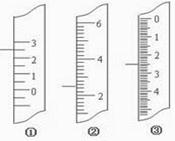
则:量筒应该是 读数为 mL,滴定管应该是 读数为 mL,温度计应该是 。
(2)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了验证其纯度,用已知浓度的盐酸进行滴定,试回答下列问题:
①称取一定质量固体试剂配制100mL溶液。
②将标准盐酸装在25.00mL 滴定管中,调节液面位置在 ,并记下刻度。
③取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂。
④下列实验操作会引起氢氧化钠含量偏高的是 。
A.滴定前滴定管尖嘴有气泡,滴定后滴定管尖嘴无气泡
B.中和滴定时,锥形瓶内有少量蒸馏水
C.酸式滴定管用蒸馏水洗后,用标准液润洗2-3次
D.读取滴定管终点读数时,仰视刻度线