微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (6分)实验室利用下图装置进行中和热的测定,请回答下列问题:
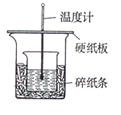
(1)在操作正确的前提下,提高中和热测定准确性的关键是?
(2)做1次完整的中和热测定实验,温度计需使用?次,
某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别
测量酸和碱的温度,你是否同意该同学的观点,为什么???;
??。
参考答案:

本题解析:略
本题难度:一般
2、选择题 下列各说法正确的是
A.对于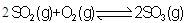
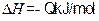 (Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ
(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ
B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示
C.需要加热才能发生的反应不一定是吸热反应
D.小苏打在水中的电离方程式: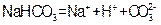
参考答案:
C
本题解析:略
本题难度:一般
3、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示甲醇燃烧热的热方程式是
A.CH4O(l)+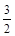 O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1
O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1
B.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=+1451.6kJ· mol—1
C.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=-22.68kJ· mol—1
D.CH4O(l)+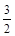 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1
O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1
参考答案:A
本题解析:1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,则1mol甲醇即16甲醇完全燃烧放出的热量是22.68kJ×16=725.8kJ。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,据此可知选项A正确,B中反应热大于0,错误;C中反应热的数值不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确燃烧热的含义以及热化学方程式书写的注意事项,然后灵活运用即可。
本题难度:简单
4、选择题 下列与化学反应能量变化相关的叙述,正确的是(? )
A.反应热就是反应放出的热量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.化学反应中的焓变仅含化学键断裂和形成的能量变化
D.同温同压下,H2(g)+Cl2(g)=2HCl(g) △H,在光照和点燃条件下反应,△H相同
参考答案:D
本题解析:反应热是指反应前后的能量变化,有放热和吸热两种,A错误;反应速率与放热和吸热无关,B错误;化学反应中的焓变不仅与化学键的形成、断裂有关,还与物质的状态有关,C错误;根据盖斯定律,反应热只与反应始末状态有关,与反应的条件无关,所以D正确;故选D。
本题难度:简单
5、选择题 下列热化学方程式书写正确的是( 的绝对值均正确)
的绝对值均正确)
A.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热)
D.2H2O==O2+2H2;△H=+571.6kJ/mol(反应热)
参考答案:A
本题解析:中和反应是放热反应,△H小于0,B不正确。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水对应的稳定状态应是液态,而不是气态,C不正确。D中没有注明物质的状态,不正确。答案选A。
本题难度:一般