微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g )?△H = -297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是(?)
A.标况下,燃烧1mol S放出的热量为297.23 kJ
B.S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ
C.S ( g ) + O2 ( g ) = SO2 ( g )放出的热量小于297.23 kJ
D.形成1 mol SO2的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
参考答案:AD
本题解析:略
本题难度:简单
2、选择题 已知反应3H2+N2 2NH3为放热反应,由此推断出 (?)
2NH3为放热反应,由此推断出 (?)
A.氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应
B.3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量
C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量
D.氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质
参考答案:C
本题解析:A.任何反应的发生都有个反应物中化学键断裂和生成物中的化学键形成的过程,因此该反应发生时要吸收热量。错误。B.由于该反应是放热反应,所以3mol氢气和1mol氮气所具有的总能量搞于2mol氨气所具有的总能量。错误。C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量,所以多余的能量就释放出来,因此该反应是放热反应。正确。D.氢气和氮气中的化学键键能较高,是较稳定的物质。由于氮气与氢气合成氨气的反应是放热反应,所以产生的氨分子也是比较稳定的物质。错误。
本题难度:一般
3、填空题 (Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为?。
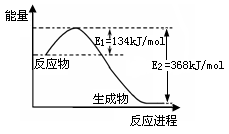
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式?。
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),?
已知:2H2(g)+O2(g)==2H2O(l) △H=" -483.6" kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H="+67.8" kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H="-92.0" kJ/mol
请计算NH3 (g)的燃烧热?。
温度
| 平衡浓度/ (mol?L-1)
|
c(NH3)
| c(CO2)
|
T1
| 0.1
| ?
|
T2
| ?
| 0.1
|
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是??
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是??
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分
| 含量/(mg?L-1)
| 成分
| 含量/(mg?L-1)
|
Cl-
| 18980
| Ca2+
| 400
|
Na+
| 10560
| HCO3-
| 142
|
SO42-
| 2560
| Br-
| 64
|
Mg2+
| 1272
| ?
| ?
|
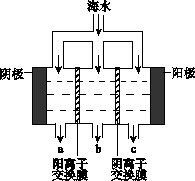 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是?。
(2)在阴极附近产生少量白色沉淀,其成分有?和CaCO3,生成CaCO3的离子方程
式是?。
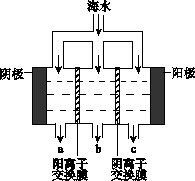 ?
?
(3)淡水的出口为?(填“a”、“b”或“c”)。
参考答案:Ⅰ、(1) 10% (1分)
(2) NO2(g) + CO(g) =" NO(g)" + CO2(g)?△H = -234KJ/mol(2分)
(3) 282.8kJ/mol(2分)?(4)D(2分)
Ⅱ、(1)(1分)2Cl—-2e—=Cl2↑
(2)(2分)Mg(OH)2;Ca2++ OH—+HCO3—=CaCO3↓+H2O (2分)(3)b(2分)
本题解析:Ⅰ(1)生成氨气0.4mol,需要氮气0.2mol,故转化率是10%。
(2)由图可知反应放热,放出的能量是368kJ/mol-134 kJ/mol=234 kJ/mol,所以其热化学方程式为NO2(g) + CO(g) =" NO(g)" + CO2(g)?△H = -234KJ/mol。
(3)考查盖斯定律的应用。将已知的3个反应分别设为①②③,则①×3-③×2+②×2即得到4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),即△H=-1131.2 KJ/mol。所以氨气的燃烧热是282.8kJ/mol。
Ⅱ(1)在电解池中阳极失去电子,根据所给的离子可知,阳极是氯离子放电,2Cl—-2e—=Cl2↑。
(2)阴极是水电离出的氢离子放电,由于氢离子放电,破坏了阴极周围水的电离使OH-浓度增大,因而会生成氢氧化镁。又因为OH-和HCO3—结合生成CO32-,进而生成碳酸钙。
(3)根据装置的特点可看出海水中的离子通过交换膜向两端移动,淡水从中间出来,即b口出淡水。
本题难度:简单
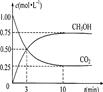
4、填空题 (6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。

(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0;
B.△H>0,△S<0;
C.△H<0,△S<0;
D.△H<0,△S>0。