微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
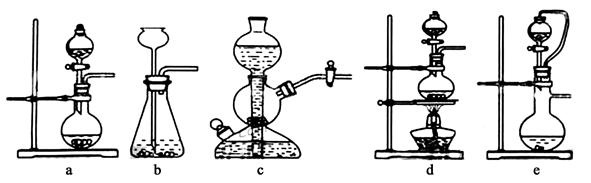
1、实验题 Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 ??(填写字母)。
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
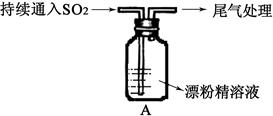
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是?。
(2)③中大量白色沉淀的成份是?。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是??。
(4)用离子方程式解释现象③中黄绿色褪去的原因:?。
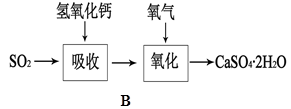
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
?。
参考答案:Ⅰ.ae (2分)
Ⅱ.⑴ 白雾中含有SO2也能与酸化的AgNO3反应生成白色沉淀(2分)
⑵CaSO4 (2分)
⑶可取适量原溶液加入一定量的稀硫酸观察到溶液变黄绿色(2分)
⑷ Cl2+SO2+2H2O=4H++2Cl-+SO42-? (2分)
⑸ SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O。}(2分)
本题解析:Ⅰ.用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc。故可选用的发生装置是ae。Ⅱ若白雾中含有SO2,也能与酸化的AgNO3反应生成白色硫酸银沉淀。SO2,也被氧化为硫酸,硫酸和次氯酸钙发生复分解反应生成磷酸钙白色沉淀。可取适量原溶液加入一定量的稀硫酸,Cl-、ClO-、H+发生归中反应得到黄绿色氯气,而使溶液变黄绿色。有氧化性Cl2和还原性的有SO2在水溶液中发生氧化还原反应生成硫酸和盐酸,从而失去氯气的黄绿色。Cl2+SO2+2H2O=4H++2Cl-+SO42-。石灰-石膏法吸收SO2的的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O}。2危害,变废为宝。
本题难度:一般
2、选择题 研究表明,SO2水溶液中存在着如下所示多个平衡,向该溶液中
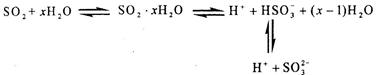
A.滴加石蕊试液,先变红后褪色
B.滴加品红溶液,先褪色后变红
C.通入硫化氢气体,溶液pH先升高后降低
D.加入足量氯化钡溶液,有白色沉淀生成
参考答案:C
本题解析:A.滴加石蕊试液,由于产生的H2SO3会电离产生H+,所以溶液变为红色。尽管SO2有漂白性,但是它只能与某些有色物质如品红结合成不稳定的无色物质。而不能使石蕊试液变红。错误。B. SO2有漂白性,它能使某些有色物质如品红变成不稳定的无色物质,而使之褪色。错误。C.通入硫化氢气体,发生反应:SO2+2H2S=3S+2H2O。上述平衡逆向移动,c(H+)减小,所以溶液的pH升高。当把溶液中的SO2反应消耗完全后,H2S在水中溶解电离:H2S 2H++S2-.所以溶液的酸性又逐渐增强,pH再下降。故溶液pH先升高后降低。正确。D.加入足量氯化钡溶液,假如发生反应:BaCl2+SO2+H2O=BaSO3↓+2HCl.但是BaSO3在酸性环境中不存在。即不能弱酸增强强酸。错误。2及其在水溶液的性质。
2H++S2-.所以溶液的酸性又逐渐增强,pH再下降。故溶液pH先升高后降低。正确。D.加入足量氯化钡溶液,假如发生反应:BaCl2+SO2+H2O=BaSO3↓+2HCl.但是BaSO3在酸性环境中不存在。即不能弱酸增强强酸。错误。2及其在水溶液的性质。
本题难度:一般
3、选择题 下列材料最不适宜储运浓硫酸、浓硝酸的是
A.铁
B.铜
C.陶瓷
D.铝
参考答案:B
本题解析:浓硫酸、浓硝酸均具有强氧化性,但常温下铁、铝和浓硫酸、浓硝酸会发生钝化,因此可以铁制容器或铝制容器来储运浓硫酸、浓硝酸;陶瓷属于无机非金属材料,主要成分是二氧化硅,二氧化硅性质稳定不溶于浓硫酸、浓硝酸,因此页可以用来储运浓硫酸、浓硝酸;铜和浓硫酸需要加热才能发生氧化还原反应,和浓硝酸在常温下即可被氧化,因此铜制容器不能用来储运浓硫酸、浓硝酸。
本题难度:简单
4、填空题 对下列事实的解释错误的是
A.在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有吸水性
B.浓H2SO4和木炭能反应,是利用浓H2SO4的强氧化性
C.浓硫酸可以用于干燥Cl2,是利用浓H2SO4的吸水性
D.反应CuSO4+H2S = CuS↓+H2SO4能进行,说明CuS既难溶于水,也难溶于稀硫酸
参考答案:A
本题解析:在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有脱水性(即:蔗糖中并无水分子,只是使蔗糖中的H、O元素按H2O的组成脱去)
本题难度:一般
5、实验题 (20分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题(由实验装置引起的实验误差忽略不计)。
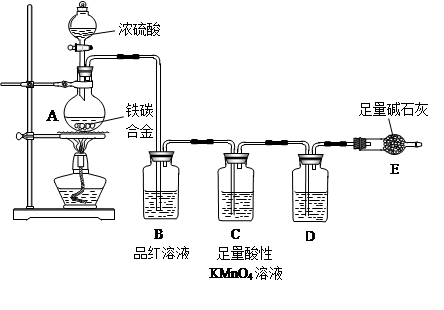
I. 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量;
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸;
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象:
写出A中发生反应的化学方程式___________________________________________(任写一个); B中的现象是________________________________________,由此可得到浓硫酸具有____________性;C中足量的酸性KMnO4溶液所起的作用是________________________;
D中盛放的试剂是_______________。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
___________________________________(任写一个)。
Ⅱ.测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,则铁碳合金中铁的质量分数为:___________________________________________(写表达式);
某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是_____________________________________________________________________;
(6)经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
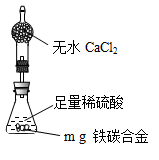
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量
参考答案:⑶2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O)(2分);?品红溶液逐渐褪色(2分);?强氧化(2分);?除去CO2中混有的SO2(2分);浓硫酸(2分);
CO2↑+2SO2↑+2H2O)(2分);?品红溶液逐渐褪色(2分);?强氧化(2分);?除去CO2中混有的SO2(2分);浓硫酸(2分);
⑷2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑,SO2+2Fe3++2H2O=2Fe2++SO42-+4H+)(2分);
⑸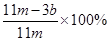 (或
(或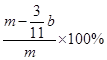 (3分)); 空气中CO2、H2O进入E管使b增大(2分)
(3分)); 空气中CO2、H2O进入E管使b增大(2分)
⑹③(3分)
本题解析:(3)浓硫酸具有强氧化性,能和铁或碳在加热的条件下反应,反应的化学方程式是2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。
CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。
(4)由于随着反应的进行,稀硫酸的浓度会逐渐降低,所以有可能生成氢气。另外如果铁过量,则氯化铁还可能氧化剩余的单质铁,同时也可能氧化生成的SO2气体,因此可能的离子方程式是2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑,SO2+2Fe3++2H2O=2Fe2++SO42-+4H+)。
(5)E装置增加的质量就是CO2的质量,所以根据碳原子守恒可知,碳的质量是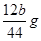 ,则则铁碳合金中铁的质量分数
,则则铁碳合金中铁的质量分数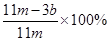 。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。
。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。
(6)由于气体的体积测量往往受温度和压强的影响,不易测量,①不正确,②态复杂。在反应中碳和稀硫酸不反应,只有铁和稀硫酸反应生成氢气和硫酸亚铁,所以可以根据质量守恒定律,常用实验③。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的--实验原理;3.结合实验材料,初步确定设计对策--实验方案。
本题难度:一般