微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:FeSO4·7H2O)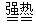 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
A.有BaSO4生成
B.有BaSO3生成
C.同时有BaSO4和BaSO3生成
D.有SO3逸出
参考答案:A
本题解析:三氧化硫溶于水生成硫酸,进而生成硫酸钡沉淀。在酸性溶液中,SO2不可能溶解,所以不可能生成亚硫酸钡沉淀,答案选A。
本题难度:一般
2、实验题 (12分)根据下图回答问题:
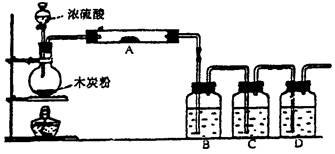
(1)写出浓H2SO4和木炭粉在加热条件下反应的化学方程式?。
(2)若用图中的装置检验上述反应的全部产物,完成下列各题:
A中加入的试剂是?,作用是?
B中加入的试剂是?,作用是?
C中加入的试剂是?,作用是?
D中加入的试剂是?,作用是?
(3)实验时,C中应观察到的现象是:?
参考答案:(1)2H2SO4(浓)+C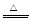 2H2O+CO2↑+2SO2↑(2分)
2H2O+CO2↑+2SO2↑(2分)
(2)A无水硫酸铜?检验H2O?
B品红溶液?检验SO2?
C酸性KMnO4溶液?吸收SO2?
D澄清石灰水?检验CO2?(每空1分)
(3)酸性高锰酸钾溶液的颜色不褪尽(或不褪色,或不褪成无色)(2分)
本题解析:(2)首先明确实验目的:检验上述反应的产物(H2O、CO2、SO2);
然后确定检验时所需试剂:通常H2O用无水CuSO4白色粉末检验(因两者反应会生成蓝色晶体:CuSO4·5H2O);CO2用澄清石灰水检验(因两者反应会生成CaCO3白色沉淀),SO2用品红溶液检验(因SO2有漂白性,能使品红褪色),
其次,明确三者的检验顺序:应先检验H2O(因检验CO2、SO2时都要用到水溶液,会带入水蒸气,则干扰产物中水的检验),再检验SO2(因SO2也能澄清石灰水变浑浊,故在检验CO2前排除SO2),最后检验CO2;
所以:A中盛放无水CuSO4白色粉末,作用:检验产物水,现象:变蓝
B中盛放品红溶液,作用:检验SO2,现象:褪色
C中盛放酸性KMnO4,作用:利用氧化还原反应除去SO2
D中盛放澄清石灰水,作用:检验CO2,现象:出现白色浑浊
(3)因SO2会干扰CO2的检验,故在C中要除尽SO2,则要求有足量的酸性KMnO4溶液,故现象为:酸性高锰酸钾溶液的颜色不褪尽(或不褪色,或不褪成无色)
本题难度:一般
3、选择题 将一张浸湿了溴水的滤纸挂在SO2气体中,滤纸会由黄色变成白色,这主要是因为(?)
A.SO2漂白了滤纸
B.SO2与Br2化合生成了无色的物质
C.反应放热使溴挥发了
D.Br2被SO2还原成无色的Br-
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (8分)已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNa HSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示。
HSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示。

试回答下列问题:
(1)写出a点反应的离子方程式_____。
(2)写出b点到c点反应的离子方程式_________。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为_________mol 。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
参考答案:
本题解析:略
本题难度:一般
5、计算题 向铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到2.24L(标准状况)气体。过滤残留固体,干燥后称量,质量减轻了7.5g。
(1)求参加反应的锌粉的物质的量
(2)原硫酸的物质的量浓度。
参考答案:(1)1.1 mol
(2)18.2mol/L
本题解析:(1)由题意知,Zn与稀硫酸反应产生0.1mol的氢气,消耗Zn0.1mol,质量减轻6.5g,固体共减轻7.5g,所以Zn与硫酸铜反应置换出铜又减轻1g,根据Zn + CuSO4 =" Cu" + ZnSO4得消耗Zn1mol,则参加反应的Zn的物质的量为1.1mol;
(2)该过程中硫酸先与Cu反应,剩余硫酸与Zn反应。
由Zn+H2SO4(稀)= ZnSO4 + H2↑知产生2.24L(标况下)H2此时消耗H2SO4为0.1mol;
由:Zn+CuSO4=Cu+ZnSO4固体减重1.0g产生硫酸铜为1mol,
由:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O知其所消耗硫酸为2mol
因此:115ml硫酸溶液中共有H2SO4为2.1mol,
C(H2SO4)=2.1mol/0.115L=18.2mol/L.
本题难度:一般