微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS
A.具有吸附性
B.溶解度小于CuS、PbS
C.溶解度与CuS、PbS相同
D.溶解度大于CuS、PbS
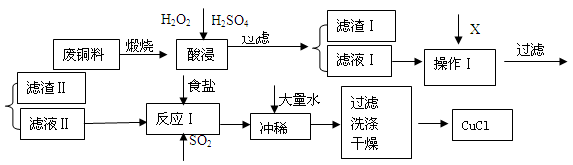
2、简答题 (14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Cu(OH)2
| 5.6
| 6.7
|
Al(OH)3
| 3.8
| 4.7
|
?
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:?。
(2)操作Ⅰ为调节溶液的PH值,范围为?,加入的物质X可以是(?)
A、CuO? B、Cu(OH)2? C、NaOH 溶液? D、CaCO3
(3)滤渣Ⅱ的主要成分是?。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:??。?
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是:?。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为:?。
CuOH + H+的平衡常数为:?。
3、简答题 难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp).已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9.
(1)将浓度均为0.1mol?L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c?(Ba2+)=______?mol?L-1.
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂,这种透视俗称钡餐透视.请用沉淀溶解平衡原理解释以下问题:
①胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是______.
②BaCO3不能代替BaSO4作为“钡餐”的原因______.
(3)万一误服了少量BaCO3,应尽快用大量0.5mol?L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为______mol?L-1.
4、选择题 相同温度下,将足量氯化银固体分别放入:①50mL蒸馏水 ②40mL 0.1 mol·L-1盐酸 ③20mL 0.1 mol·L-1氯化镁溶液 ④30mL0.1 mol·L-1硝酸银溶液中,Ag+浓度:
A.①>④=②>③
B.④>①>②>③
C.④=②>①>③
D.①>④>②③
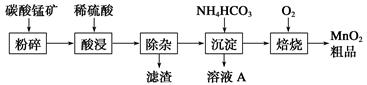
5、填空题 工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Pb(OH)2
| Mn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 8.0
| 8.3
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.8
| 9.8
|
?
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。