微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在0 ℃、101 kPa时进行下列实验:甲、乙、丙各取30.0 mL同浓度的盐酸,加入同一镁铝合金粉末产生气体,有关数据列表如下:
实验序号
| 甲
| 乙
| 丙
|
合金质量/mg
| 510
| 765
| 918
|
气体体积/mL
| 560
| 672
| 672
|
(1)盐酸的物质的量浓度为____________。
(2)合金中镁的质量分数为____________,铝的质量分数为____________。
参考答案:(1)2.00 mol·L-1?(2)47.1%? 52.9%
本题解析:此题考查镁、铝单质的化学性质。
(1)由表中数据可推知乙、丙实验中盐酸不足。
n(HCl)=2n(H2)=2×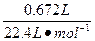 ="0.060?" 0 mol
="0.060?" 0 mol
所以,n(HCl)=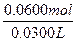 ="2.00" mol·L-1。
="2.00" mol·L-1。
(2)由表可知甲实验中盐酸过量,镁、铝合金不足。
设甲中Mg、Al的物质的量分别为x、y,
Mg?—? 2HCl
x? 2x
Al?—? 3HCl
y? 3y
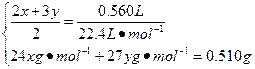
解得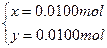
所以,合金中镁的质量分数为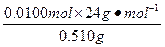 ×100%=47.1%,
×100%=47.1%,
铝的质量分数为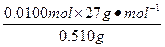 ×100%=52.9%。
×100%=52.9%。
本题难度:简单
2、选择题 (原创题)某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。

下列说法正确的是( )
A.NaOH溶液可以用氨水来代替
B.溶液a只含有Al3+、K+、Cl-、Na+、OH-
C.溶液b中只含有NaCl
D.向溶液a中滴加盐酸需控制溶液的pH
参考答案:D
本题解析:A项用氨水将会使Al3+、Mg2+均沉淀下来,达不到分离的目的;B项a中不再含有Al3+,转化为AlO2—;C项b中含有KCl、NaCl、HCl等物质;D项若不控制pH,沉淀Al(OH)3将不能分离出来。
本题难度:一般
3、选择题 将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.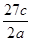
B.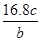
C.
D.
参考答案:C
本题解析:氢气的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为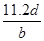 ;铝的物质的量是
;铝的物质的量是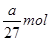 ,转移电子的物质的量是
,转移电子的物质的量是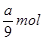 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为 ,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
点评:该题的关键是明确反应的原理,以及微粒个数与阿伏加德罗常数的关系,如何结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力。
本题难度:一般
4、选择题 逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是
[? ]
A.单质都是由同种元素组成的,只含一种元素的物质一定是纯净物
B.金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
参考答案:D
本题解析:
本题难度:简单
5、实验题 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
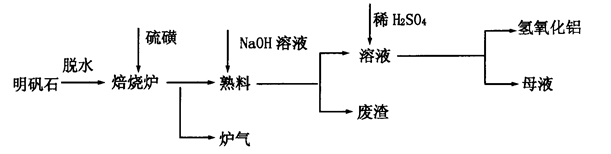
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
参考答案:(14分)(1)Al2(SO4)3(2分);3.612×1024(2分) (2)Al2O3+3H2O+2OH-=2[Al(OH)4]-(2分)
(3)K2SO4、Na2SO4(2分,每式1分,有错误不得分)
(4)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)(3分,有错不得分)
(5)取少量废渣,加入适量稀H2SO4,溶解后滴加KSCN溶液,溶液变红色,说明废渣中含有Fe2O3(3分,步骤、现象和结论各1分)
本题解析:(1)根据方程式可知,反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,得到2个电子,发生还原反应,所以Al2(SO4)3是氧化剂。反应中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×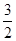 =1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。
=1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。
(2)氧化铝是两性氧化物,能溶于氢氧化钠溶液中,所以由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应离子方程式为Al2O3+3H2O+2OH-=2[Al(OH)4]-。
(3)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、[Al(OH)4]-、OH-等,加硫酸调pH值,[Al(OH)4]-转化为Al(OH)3沉淀而析出,母液中离子主要有K+、Na+、SO42-,因此含有溶质为K2SO4、Na2SO4。
(4)标准状况下1.12L二氧化硫的物质的量为1.12L÷22.4L/mol=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,即n(SO2): n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3。溶液呈酸性,说明HSO3-的电离程度大于其水解程度,同时水电离生成氢离子,所以溶液中c(H+)>c(SO32-)。HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,因此溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
(5)由工艺流程可知,废渣的主要成分为Fe2O3,可以通过检验铁离子来检验氧化铁。即取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3。
本题难度:一般