微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)有一定质量的镁铝合金,将其平均分成两份。第一份加入到100m L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?②
L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?② 盐酸的质量分数是多少?
盐酸的质量分数是多少?
参考答案:(6分)①2.4克;②13.3%。
本题解析:略
本题难度:一般
2、选择题 将氢氧化钠溶液滴入某混有盐酸的氯化镁和氯化铝的混合溶液中,则下列图像变化趋势正确的是:
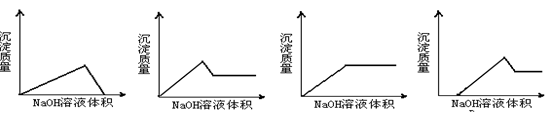
A? B? C? D
参考答案:D
本题解析:滴加氢氧化钠首先中和盐酸,当盐酸被中和之后,再滴加氢氧化钠则生成氢氧化镁和氢氧化铝沉淀。当沉淀不再变化时,继续滴加氢氧化钠,则氢氧化铝将被溶解,沉淀质量减小。所以正确的答案是D。
本题难度:一般
3、填空题 铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:______
(2)铝与NaOH溶液反应的离子方程式为:______.
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
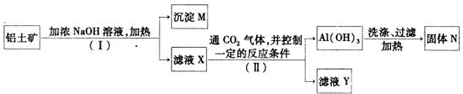
①I和II步骤中分离溶液和沉淀的操作是;______;
②沉淀M中除含有泥沙外,一定还含有______,固体N是______;
③滤液X中,含铝元素的溶质的化学式为______,它属于______(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入______(填“氨水”或“NaOH溶液”)来制取A1(OH)3.其反应的离子方程式为:______.
参考答案:(1)铝与氧化铁发生铝热反应的化学方程式为:2 Al+Fe2O3?高温?.?Al2O3+2Fe,故答案为:2 Al+Fe2O3?高温?.?Al2O3+2Fe;
(2)金属铝和强碱氢氧化钠反应的实质是:2Al+2OH-+2H2O=2AlO2+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2+3H2↑;
(3)A12O3、Fe2O3、SiO2中加入浓的氢氧化钠溶液时,其中的A12O3、SiO2会与之发生反应分别生成偏铝酸钠和硅酸钠的水溶液,即为滤液X,所以沉淀M主要是Fe2O3,偏铝酸钠和过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,硅酸钠和过量的二氧化碳反应生成碳酸氢钠和硅酸沉淀.
①分离溶液和沉淀的操作是过滤,故答案为:过滤;
②沉淀M除含有泥沙外,主要是Fe2O3,氢氧化铝受热易分解生成氧化铝和水,所以固体N是Al2O3,故答案为:Fe2O3;Al2O3;
③滤液X中,含铝元素的溶质是偏铝酸钠,化学式为NaAlO2,属于盐类,故答案为:NaAlO2;盐;
④实验室里常往AlCl3溶液中加入氨水可以制取氢氧化铝,氢氧化铝不溶于弱碱,反应原理为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:氨水;Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
本题解析:
本题难度:一般
4、填空题 铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是?。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为?。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=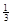 Na3AlH6 (s)+
Na3AlH6 (s)+ 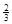 Al (s) + H2(g)?ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g)?ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 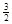 H2(g)?ΔH=+ 70.5 kJ·molˉ1
H2(g)?ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +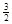 H2(g)?ΔH=?。
H2(g)?ΔH=?。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为?。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为?。
参考答案:(9分)(1)常温下,铝易被浓硝酸、浓硫酸钝化
(2)LiAlH4、AlCl3?(3)+ 60.5 kJ·molˉ1
(4)① 3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)?
② 3.6 (2分)?③ 2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑
本题解析:(1)常温下,铝易被浓硝酸、浓硫酸钝化,所以浓硝酸、浓硫酸可贮存在铝制容器中。
(2)根据反应的方程式可知,铝元素的化合价从+3价降低到0价,得到电子,发生还原反应,所以氧化剂是LiAlH4、AlCl3 。
(3)根据盖斯定律可知,①+②×1/3,即得到反应式NaAlH4(s)=" NaH(s)" + Al (s) + H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
(4)①原电池中正极得到电子,则根据总的反应式可知Al失去电子,做负极,所以正极反应式是3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)。
②普通锌锰干电池中负极是锌,65g锌失去2mol电子,而65g铝失去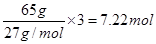 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
③铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑。
点评:该题是中等难度的试题,试题设计新颖,基础性强,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲,也有利于培养学生的规范答题能力和逻辑推理能力,提高学生的学习效率。
本题难度:困难
5、推断题 下图所示转化关系中,B、C、F都是单质,其中C是紫红色固体,F是银白色固体,B是空气的主要成分之一;化合物G是常用的耐火材料,D溶液中加入氯化钡溶液,产生白色沉淀。
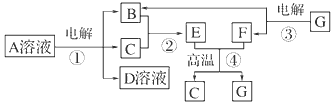
试回答下列问题:
⑴反应①~④中,属于置换反应的是________(填序号)。
⑵写出反应①的化学方程式________________________________。
⑶G与D溶液反应的离子方程式__________________________________。
⑷生成等物质的量的B时,反应①和③消耗的A、G的物质的量之比为________。
⑸用C、F作两电极,并用导线相连: ①两电极同时插入稀H2SO4中,F上的电极反应式为
___________________________。
②两电极同时插入浓HNO3中,F上的电极反应式为_____________________________。
参考答案:(1)④
(2)2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
(3)Al2O3+6H+=2A l3++3H2O
(4)3:1
(5)①Al-3e=Al3+;②NO3-+2H++e-=NO2↑+H2O
本题解析:
本题难度:一般