微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是(? )
A.水的离子积常数Kw随温度改变而改变,随外加酸碱浓度改变而改变
B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大
C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
参考答案:D
本题解析:A项,水的离子积常数Kw只与温度有关,不随外加酸碱浓度的改变而改变,故A错误;B项,电离常数Ka是表示弱电解质电离程度大小的物理量,Ka值越大,表示该一元弱酸电离程度越大,B错误;C项,平衡常数(K)只与温度有关,与浓度无关,故C错误。
本题难度:一般
2、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
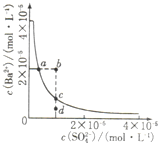
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故A错误;
B、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,所以不能使溶液由d点变到c点,故B错误;
C、b点表示Qc>Ksp,溶液过饱和,会有沉淀析出,故C正确;
D、Ksp是溶度积常数,只随着温度的改变而改变,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D错误;
故选C.
本题解析:
本题难度:一般
3、简答题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
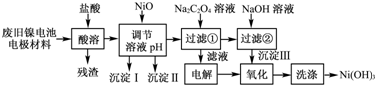
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | |
pH
开始沉淀
沉淀完全
Al(OH)3
1.9×10-23
3.4
4.2
Fe(OH)3
3.8×10-38
2.5
2.9
Ni(OH)2
1.6×10-14
7.6
9.8
|
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀Ⅰ______和沉淀Ⅱ______(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:______.
(3)检验电解滤液时阳极产生的气体的方法:______.
(4)写出“氧化”反应的离子方程式:______.
(5)如何检验Ni(OH)3已洗涤干净?______.
参考答案:(1)根据表中开始沉淀和沉淀完全PH,Fe(OH)3开始沉淀PH2.5沉淀完全PH2.9,Al(OH)3开始沉淀3.4沉淀完全PH4.2,故答案为:Fe(OH)3 Al(OH)3
(2)NiCl2可与Na2C2O4反应生成NiC2O4?2H2O和NaCl,故答案为:NiCl2+Na2C2O4+2H2O═NiC2O4?2H2O↓+2NaCl
(3)滤液为氯化钠溶液,电解时阳极产生氯气,氯气有强氧化性,故可用湿润的淀粉碘化钾试纸,故答案为:用湿润的淀粉碘化钾试纸
(4)过滤2得到Ni(OH)2电解滤液1产生氯气,二者发生氧化还原反应,离子方程式为2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-,故答案为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(5)取最后一次洗涤浸出液,加入硝酸银溶液,若有白色沉淀生成,则说明未洗涤干净,若无白色沉淀,说明已洗涤干净,故答案为:取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
本题解析:
本题难度:一般
4、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断