微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知1mol Na2S2O3溶液恰好把4mol Cl2完全转化为Cl-离子,则S2O32-将转化成?(?)
A. SO42-
SO42-
B.S
C.SO32-
D.S2-
2、选择题 下列溶液中通入SO2一定不会产生沉淀的是
A.Ba(OH)2
B.Ba(NO3)2
C.Na2S
D.BaCl2
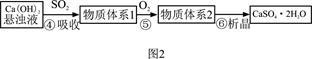
3、填空题 下图1是工业上“碱法烟气脱硫法” 示意图,下图2是工业上“石灰→石膏烟气脱硫法”示意图,回答:

已知:
试?剂
| Ca(OH)2
| NaOH
|
价格(元/kg)
| 0.36
| 2.9
|
吸收SO2的成本(元/mol)
| 0.027
| 0.232
|
?
(1)图1中,反应①的离子方程式为?,之一是??。
(2)图2中,反应⑤的目的是稳定固化硫元素形成高价态的化合物,氧气的作用是?。该法的优点之一是?。
(3)“碱法烟气脱硫法”中的产物Na2SO3的稳定性不好,易使硫元素重新转化为挥发性污染物,为避免之,设计了③的反应,写出其化学方程式为?。
4、实验题 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善。已知SO2可以用Fe( NO3)3溶液吸收, 0.1mol/L的Fe(NO3)3溶液的pH=2。某学习小组据此展开如下相关探究:
【探究I】铜与浓硫酸的反应探究:
(l)取12.8g铜片于三颈烧瓶中,通N2一段时间后再加入20 mL 18 mol?L-1的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀,充分反应后,烧瓶中仍有铜片剩余。

①该小组同学认为烧瓶中除有铜片剩余外还应有较多的硫酸剩余,其原因是: ___________________?。
②该小组同学欲通过测定产生气体的量来求余酸的物质的量,设计了多种实验方案。下列方案不可行的是______?。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量硫酸酸化的高锰酸钾溶液后,再加入足量的BaCl2溶液,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
【探究II】装置B中产生沉淀的原因探究:
(2)加入浓硫酸之前先通N2一段时间,其目的是____?。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列猜想(不考虑各因素的叠加):
猜想1: 装置A中的白雾进入B参与反应
猜想2:SO2被Fe3+氧化为SO42-
猜想3:?。
(4)甲同学认为只要在装置A、B间增加洗气瓶C,就可以排除装置A中白雾影响,则C中盛放的试剂是?。
(5)乙同学取出少量装置B中清液,加入几滴酸性高锰酸钾,发现紫红色褪去,据此认为猜想2成立。你是否同意其结论?并说明理由:?。
【思考与交流】
(6)实验结束后,若使烧瓶中铜片继续溶解,下列方案(必要时可加热)可行的是?。
A.打开弹簧夹,通入O2? B.由分液漏斗加入H2O2溶液
C.由分液漏斗加入NaNO3溶液?D.由分液漏斗加入Na2SO4溶液
5、选择题 有关硫酸的下列反应中,没有表现出硫酸氧化性的是(?)
A.浓硫酸与铝的反应
B.稀硫酸与纯碱的反应
C.稀硫酸与锌的反应
D.浓硫酸与木炭的反应