|
高中化学知识点归纳《能量的相互转化》高频考点强化练习(2017年最新版)(二)
2017-03-05 15:52:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
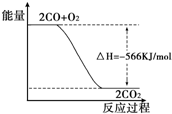
1、选择题 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol根据以上热化学方程式判断,下列说法错误的是( )
A.CO2气体分解生成CO气和O2气体的反应是放热反应
B.CO气体与O2气体生成CO2气体的反应是放热反应
C.右图可表示由CO气体生成CO2气体的反应过程和能量关系
D.在相同条件下,2?mol?CO气体与1?mol?O2气体的能量总和大于2?mol?CO2气体的能量
| 
参考答案:A.CO和O2反应生成CO2是放热反应,则CO2气体分解生成CO气和O2气体的反应是吸热反应,故A错误;
B.由2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol可知CO气体与O2气体生成CO2气体的反应是放热反应,故B正确;
C.该图描述的就是一个热化学方程式,对应566的数值应该是2CO(g)+O2(g)和2CO2,故C正确;
D.放热反应中反应物的总能量大于生成物的总能量,所以在相同条件下,2?mol?CO气体与1?mol?O2气体的能量总和大于2?mol?CO2气体的能量,故D正确;
故选:A;
本题解析:
本题难度:简单
2、填空题 (本题16分)工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)? ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)?ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)?ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________ ________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题: HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①脱氢反应的△H_____0,600K时,Y点甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②从Y点到X点可采取的措施是_______________________________________________。
③有同学计算得到在t?1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由__________________________________________________________________________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3-OH的脱氢实验:
CH3OH(g) HCHO(g)+H2(g) HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号
| 温度
| 0
| 10
| 20
| 30
| 40
| 50
| ①
| T1
| 0.050
| 0.0492
| 0.0486
| 0.0482
| 0.0480
| 0.0480
| ②
| T1
| 0.050
| 0.0488
| 0.0484
| 0.0480
| 0.0480
| 0.0480
| ③
| T2
| 0.10
| 0.094
| 0.090
| 0.090
| 0.090
| 0.090
|
可以判断:实验①的前20?min的平均反应速率?ν(H2)=?;实验温度T1?T2(填“>”、“<”);催化剂的催化效率:实验①?实验②(填“>”、“<”)。
(4)用CH3-OH、空气、KOH溶液和石墨电极可构成燃料电池。则该电池的负极反应式为:
___________________________________________。
参考答案:
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l)?ΔH=﹣442.8 kJ∕mol?(2分)
(2)①> (2分)②< (2分)
②降低温度和增大压强(2分)
③不正确(1分)。因为当CH3OH的起始浓度不同时,其转化率就不等于90%。(1分)
(3)7.0×10-5 mol·L-1 min-1(2分)? <(1分) <(1分)
(4)CH3-OH + 8OH- + 6e- = CO32- + 6H2O (2分)
本题解析:
(1)根据题意,先写出甲醇不完全燃烧生成一氧化碳和液态水的化学方程式,标明状态,再根据盖斯定律求算焓变。
(2)①由坐标图可知,随着温度的升高,甲醇的平衡转化率在不断地增大,即是温度升高,平衡向正反应方向移动,所以焓变大于0;②Y点在曲线的上方,在该温度下,平衡转化率应比Y点小,所以平衡当向逆进行,才能达到X点,所以正反应速率小逆反应速率;可以采用降温或增大压强的方法;③不正确,起始浓度不一样,转化率就不同了。
(3)审清题意“实验①的前20?min,ν(H2)”,ν(H2)=(0.050-0.0486)mol·L-1/20min
;该反应是吸热反应,比较实验①和实验②达到平衡所需要的时间,便可判断温度的高低和催化剂的催化效果;
(4)负极发生的是氧化反应,所以先把这一部分CH3-OH -6e- → CO32-写出来,因为电解质溶液是碱性的,C以CO32-存在,由电荷守恒可知,左边当再加上OH-,右边加上H2O,配平就可以了。
本题难度:一般
3、选择题 下列实验过程中,发生吸热反应的是(?)
A.铝粉与氧化铁粉末反应
B.乙醇燃烧
C.碳酸钙受热分解
D.碘单质升华
参考答案:C
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。 所以选项C是吸热反应,AB都是放热反应,选项D吸热,但是物理变化,答案选C。
本题难度:简单
4、选择题 已知H2(g)+Cl2(g)="2HCl(g)" ?△H =" ―184.6" kJ·mol-1,下列说法中正确的是
A.该反应为吸热反应
B.H2的能量一定高于HCl
C.反应HCl(g)=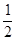 H2(g)+ H2(g)+ 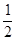 Cl2(g) 的 △H为 +92.3 kJ·mol-1 Cl2(g) 的 △H为 +92.3 kJ·mol-1
D.该反应为放热反应,故不必加热就可发生反应
参考答案:C
本题解析:△H小于0,是放热反应,A不正确;反应放热,说明反应物的总能量高于生成物的总能量,B不正确;反应条件和反应是否放热或吸热无关系,D不正确。正反应是放热反应,则逆反应就是吸热反应,C正确,答案选C。
点评:该题是中等难度的试题,试题基础性强,主要是考查学生对反应热概念的了解掌握程度,有助于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
5、选择题 氢氧化钠和盐酸的反应属于(?)
A.放热反应
B.吸热反应
C.既是吸热反应,又是放热反应
D.都不是
参考答案:A
本题解析:中和反应是放热反应。
点评:判断一个反应为吸热反应或放热反应,是历年高考的常考题型,考生可根据反应基本类型进行判断,并注意积累特殊的化学反应的反应热。
本题难度:简单
| 