微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( ? )
?
| A
| B
| C
|
Ⅰ
| 0.050mol·L-1
| 0.050mol·L-1
| 0.050mol·L-1
|
Ⅱ
| 0.070mol·L-1
| 0.070mol·L-1
| 0.098mol·L-1
|
Ⅲ
| 0.060mol·L-1
| 0.060mol·L-1
| 0.040mol·L-1
|
Ⅳ
| 0.080mol·L-1
| 0.080mol·L-1
| 0.12mol·L-1
|
?
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
2、填空题 “氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。
A. 2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B. H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C. 2H2+O2=2H2O(l) △H=-571.6 kJ/mol
D. H2(g)+1/2O2(g)=H2O(g) △H=-285.8 kJ/mol
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______
______
④2HgO2 Hg+O2↑
Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:__________________。根据“绿色化学”的思想评估该方法制H2的主要缺点:_______。
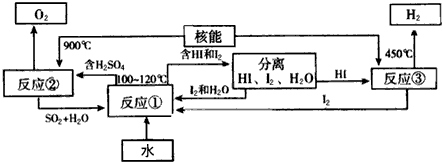
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O) 完成下列反应的化学方程式:
反应①_______________;反应②_____________。此法制取氢气的最大优点是__________________
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g)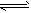 CO2(g)+H2(g) △H<0 在850℃时,
CO2(g)+H2(g) △H<0 在850℃时,
K=1。
(1)若升高温度到950℃时,达到平衡时K_____(填“大于”“小于”或“等 于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、 1.0 molCO2和xmol H2,则 ①当x=5.0时,上述平衡向_____(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_____(填“大于”“小 于”或“等于”)b。
V.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O 在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8 g,其中含单质铜与氧化亚铜的物质的量之比是_____;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体_______g;
(3)若将6 8 g上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1. 568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分
是_______,其物质的量之比是_______;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤出来,得晶体23. 68 g。经分析,原溶液中的Cu2+有
20%残留在母液中。求所得晶体的化学式:_______。
3、选择题 在盛有足量M的体积可变的密容器中加入N,发生反应:M(s)+2N(g) 4P (g)+Q(g)
4P (g)+Q(g)
 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
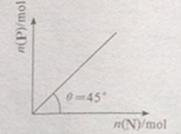
A.平衡时N的转化率为50%
B.当温度升高后,则图中 >45
>45
C.若再加入N,则正、逆反应速率均逐渐增大
D.若再加入N,则反应体系中气体密度减小
4、选择题 某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g)  Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
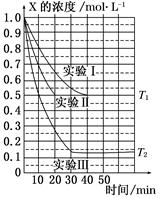
A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂
B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应
C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同
D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1
5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
|
初始浓度/mol·L-1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
|

 下列说法正确的是:
下列说法正确的是:
 A.反应达到平衡时,X的转化率为60%
A.反应达到平衡时,X的转化率为60%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数