微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:______
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式:______.
参考答案:(1)当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,1mol丁烷完全燃烧放热2900KJ;依据燃烧热概念写出热化学方程式:C4H10(g)+132O2(g)=4CO2(g)+H2O(l)△H=-2900KJ/mol,故答案为:C4H10(g)+132O2(g)=4CO2(g)+H2O(l)△H=-2900KJ/mol;
(2)设碳粉xmol,则氢气为(0.2-x)mol,则
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
1? ?393.5kJ
x? 393.5xkJ
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
2? 483.6kJ
(0.2-x)mol?241.8(0.2-x)kJ
所以393.5xkJ+241.8(0.2-x)kJ=63.53kJ,
解得x=0.1mol,
则炭粉与H2的物质的量之比为0.1mol:0.1mol=1:1;
故答案为:1:1;
(3)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
依据盖斯定律计算①×3-③×2+②得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0KJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0KJ/mol.
本题解析:
本题难度:一般
2、填空题 (10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为 ,它的沸点比PH3的沸点 ,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)____ ____(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ______,Y的第一电离能比X的______ __(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是___________ ___________________。
参考答案:(1)NH3高弱(3分):
(2 大(3分):
(3)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(2分):
(4)2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1(2分):
本题解析:导致酸雨的主要物质是氮和硫的氧化物,即W是N,Y是S。X的基态原子核外有7个原子轨道填充了电子,根据构造原理可知该原子的电子排布式为1s22s22p63s23p1,是铝元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,根据物理性质可知应该是铜的氧化物,即Z为铜。
(1)氨气中存在氢键,沸点高。非金属性越强,相应氢化物的稳定性越强。
(2)根据构造原理可写出Y的基态原子核外电子排布式,即1s22s22p63s23p4。非金属性越强,第一电离能越大,S是非金属性强,铝是金属,所以第一电离能S的大。
(3)浓硫酸在加热时可以氧化单质铜,方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
(4)考查盖斯定律的应用。由①Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1和②2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1可计算,即②-①×3可得到2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1。
本题难度:一般
3、填空题 (6分)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
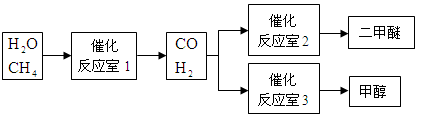
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH= -90.8kJ·mol-1
CH3OH(g) ΔH= -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH= -23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH= -41.3kJ·mol-1
CO2(g)+H2(g) ΔH= -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH= 。
CH3OCH3(g)+CO2(g);ΔH= 。
参考答案:(1)H2O+CH4一定条件CO+3H2(3分,不写条件扣1分)
(2)-246.4kJ·mol-1(3分,漏写单位扣1分)
本题解析:(1)从流程可知、水和甲烷反应生成一氧化碳和氢气,所以方程式为:H2O+CH4一定条件CO+3H2。(2)根据盖斯定律,①×2+②+③,计算反应热为-246.4kJ·mol-1。
考点:盖斯定律。
本题难度:一般
4、填空题 已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、 948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为: 。
参考答案:N2(g)+3H2(g) ="==" 2NH3 (g) △H=-90kJ·mol-1
本题解析:N2、H2合成NH3的化学方程式为N2+3H2 ="==" 2NH3,放出的热量
Q=391×6-436×3-948="90" kJ,所以N2、H2合成NH3的热化学方程式为
N2(g)+3H2(g) ="==" 2NH3 (g) △H=-90kJ·mol-1
考点:热化学方程式的书写
点评:本题考查了热化学方程式的书写,注意要标明各物质的状态。本题不难。
本题难度:一般
5、填空题 Ⅰ以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工业.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)

CO(g)+H2(g)△H=+131.3kJ?mol-1,
该反应在常温下______自发进行(填“能”与“不能”);在一体积为2L的密闭容器中,加入1molC和2mol?H2O(g),达平衡时H2O的转化率为20%,请计算此时的平衡常数______
(2)目前工业上有一种方法是用CO与H2反应来生产甲醇.
| 化学键 | C-O | C-H | H-H | C≡O | O-H
|
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463
|
已知生成气态甲醇,CO里面含C≡O.请写出该反应的热化学方程式为______
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)

2NH3(g)△H=-92.4kJ/mol
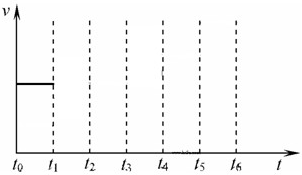
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.则通丙烷的电极发生的电极反应为______
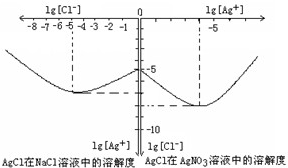
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-=[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为______.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:______.
参考答案:Ⅰ(1)该反应为熵增大,焓增大的反应,由△G=△H-T△S,△G<0反应可自发进行,可知该反应在高温时可以自发进行,常温下难以自发进行.
参加反应的水的物质的量为2mol×20%=0.4mol,则
对于反应? C(s)+H2O(g)

CO(g)+H2(g),
开始(mol):1? 2? 0?0
变化(mol):0.4?0.4?0.4
平衡(mol):1.6?0.4?0.4
所以平衡时H2O的浓度为1.6mol2L=0.8mol/L,CO和H2的浓度为0.4mol2L=0.2mol/L,
所以平衡常数k=c(CO)?c(H2)c(H2O)=0.2×0.20.8=0.05,
故答案为:不能自发进行;0.05;
(2)对于CO(g)+2H2(g)=CH3OH(g),反应热△H=1072KJ/mol+2×436KJ/mol-(413KJ/mol×3+358KJ/mol+463KJ/mol?)=-116?KJ/mol,
所以该反应的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-116?KJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-116?KJ/mol;
(3)在t1时升高温度,正逆反应速率都增大,反应为放热反应,升高温度平衡向逆反应移动,逆反应速率增大多,t2重新达到平衡,平衡时速率比原来高;
t3时充入氮气,平衡向正反应移动,生成物氨气的浓度增大,逆反应速率增大,t4时重新达到平衡;
t5时移去一部分产物,氨气浓度降低,平衡向正反应移动,反应物浓度降低,正反应速率降低,t6时又达到平衡.
据此作图为
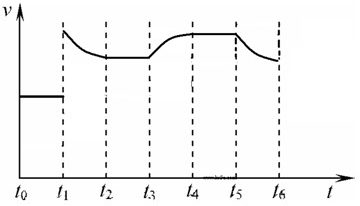
,故答案为:

;
(4)负极发生氧化反应,所以丙烷应在负极上通入,丙烷失去电子与氧离子反应,生成二氧化碳和水,电极反应式为C3H8+10O2--20e-=3CO2+4H2O,
故答案为:C3H8+10O2--20e-=3CO2+4H2O;
Ⅱ(1)由图可知AgCl的溶度积Ksp(AgCl)=c(Ag+)?c(Cl-)=10-5×10-7=10-12,故答案为:10-12;
(2)开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了,
故答案为:开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了.
本题解析:
本题难度:简单