| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《反应速率与平衡的有关计算》高频考点预测(2017年最新版)(十)
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是:___。 CO(g)+2H2(g),此反应能自发进行的原因是:___。(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程: 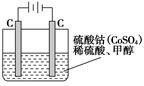 ①写出阳极电极反应式_______________; ②写出除去甲醇的离子方程式___________________。 参考答案:(1)CH4(g)+H2O(g) 本题解析:(1)根据盖斯定律,将两个已知的热化学方程式相加可得:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1。 本题难度:困难 4、计算题 工业制硫酸时,利用催化氧化反应将 |
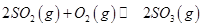 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。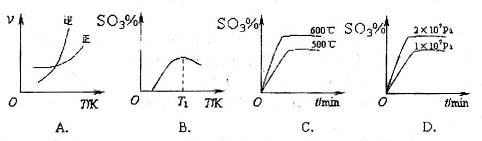
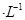 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 参考答案:(每空2分)
(1)10/3或3.33
(2)A、D
(3)C
(4)2SO2 – 4e? + 4H2O = 2SO42? +8H+? 1.12L? 1
耗费大量的电能,不经济;产率低,不能大规模生产
本题解析: (1)转化的SO2为:196kJ÷98kJ?mol?1=2mol,根据三行式计算:
SO2? + 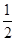 O2?
O2? ?SO3
?SO3
初始浓度(mol?L?1)? 0.04? 0.1? 0
转化浓度(mol?L?1)? 0.02? 0.01? 0.02
平衡浓度(mol?L?1)? 0.02? 0.09? 0.02
可得平衡常数K=0.02÷(0.02× =10/3
=10/3
(2)A、增加SO3,平衡逆向移动,三者浓度都增大;B、N2与反应无关,三者浓度都不变;C、保持压强不变,充入SO3,根据等效平衡原理,三者浓度不变;D、加压后各物质的浓度都大于原平衡;E、升高温度,平衡逆向移动,SO2、O2浓度增大,SO3浓度减小。
(3)A、温度升高,平衡逆向移动,逆反应速率增加的倍数大,正确;B、图像的前半段为反应建立平衡的过程,SO3%逐渐增大,T1之后的阶段为化学反应随温度的升高平衡移动的过程,升高温度,平衡逆向移动SO3%逐渐减小,图像正确;C、600℃高于500℃,平衡逆向移动,SO3%逐渐减小,图像错误;D、增大压强,平衡正向移动,SO3%增大,图像正确。
(4)①阳极上发生失电子反应,SO2失电子生成SO42?。
②V(SO2) =0.1mol÷2×22.4L/mol=1.12L;
pH=-lg(0.1mol×2÷2L)=1
③电解需要消耗大量的电能,所以本设计耗费大量的电能,不经济;产率低,不能大规模生产。
本题难度:困难
5、填空题 已知: 时,在2L固定容积的密闭容器中充入2mol
时,在2L固定容积的密闭容器中充入2mol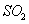 和2mol
和2mol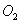 ,10分钟后达到平衡,
,10分钟后达到平衡,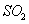 浓度和时间关系如图。
浓度和时间关系如图。
回答下列问题
(1)前5分钟内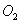 的平均反应速率为?
的平均反应速率为?
(2)能说明上述反应一定达到平衡的条件是?
A.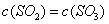
B.气体总物质的量不变
C.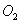 的浓度保持不变
的浓度保持不变
D. )
)
(3)平衡时,02的转化率为?,此时反应共?(填“放出”或“吸收”)的热量为?kJ。该温度下的平衡常数K=?.
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达 到新平衡,此时 ,请在图上画出15-25分钟
,请在图上画出15-25分钟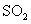 的浓度变化曲线。
的浓度变化曲线。
参考答案:(1)0.06 mol·L-1·min-1?(2分,数值对单位不写扣1分)
(2)BC?(2分,漏答给1分,错答不给分)
(3)0.4?放出? 156.8? 26.7?(每空2分)
(4)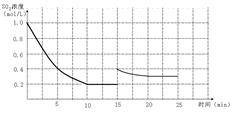 (2分)
(2分)
本题解析:(1)根据图像可知,前5分钟内SO2的浓度减少了1.0mol/L-0.4mol/L=0.6mol,所以根据方程式可知,氧气的浓度就应该减少0.3mol/L,所以氧气的平均反应速率为0.3mol/L÷5min=0.06mol·L-1·min-1。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项A不正确。该反应是体积减小的可逆反应,所以当气体的总的物质的量不再发生变化时,可以说明,B正确。D中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明,因此答案选BC。
(3)平衡时SO2的浓度是0.2mol/L,则消耗SO2的浓度是0.8mol/L,则消耗氧气的浓度是0.4mol/L,生成三氧化硫的浓度是0.8mol/L,所以氧气的转化率是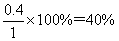 ,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K=
,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K=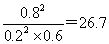 。
。
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,则相当于是增大压强,平衡向正反应方向移动,SO2的浓度先是瞬间变为0.4mol/L,然后慢慢的降低,但平衡时仍然大于0.2mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难度较大,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查灵活运用基础知识解决实际问题的能力。有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学科素养。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《生活中的有.. | |