微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 SO3分子的构型为平面三角形,它采用的杂化类型是( )?
A.sp杂化?
B.sp2杂化?
C.sp3杂化?
D.没有杂化,只有三个σ键
参考答案:B?
本题解析:SO3分子中S的价电子对数是3,所以采取的是sp2杂化,3个sp2杂化轨道呈平面三角形,又由于3个杂化轨道均与O原子形成化学键,所以分子的构型也为平面三角形。
本题难度:简单
2、填空题 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
|
B元素原子的核外p电子总数比s电子总数少1
|
C原子p轨道上成对电子数等于未成对电子数,且与A同周期
|
D元素的族序数与周期数的差为4,且不与A元素在同一周期
|
E位于周期表中第七列
|
F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
|
(1)A的基态原子最外层有?种不同运动状态的电子,F位于?区。
(2)E2+的基态核外电子排布式为?,AD4为?(填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是?(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是?,与AC2互为等电子体的分子的名称为?。(只写一种)
(4)BD3 中心原子的杂化方式为?,其分子空间构型为?。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为?;F的原子半径是?pm;(阿伏加德罗常数为NA)。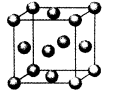
参考答案:(1)4(1分),ds(1分)
(2)1s2 2s2 2p6 3s2 3p63d5或【Ar】3d5(2分),非极性(1分)
(3)C < N< O(1分)?,B为N,C为O,N原子价电子排布为2s22p3,而O原子的价电子排布为2s22p4,N原子2p轨道半充满,较稳定。(2分) 一氧化二氮(1分)
(4)sp3?三角锥形?(各1分)
(5) 12 ;(1分)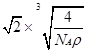 ×1010;(3分)
×1010;(3分)
本题解析:A原子核外电子分占3个不同能级,即1s、2s和2p能级,且每个能级上排布的电子数相同,则每个能级上各有2个电子,故A为C;B元素原子的核外p电子总数比s电子总数少1,B元素的s电子有4个,则p电子有3个,故B为N;C原子p轨道上成对电子数等于未成对电子数,且与A同周期,则p轨道上有4个电子,C为O;D元素的族序数与周期数的差为4,且不与A元素在同一周期,故D为第三周期,族序数为7,则D为Cl;E位于周期表中第七列,第四周期,故E为Mn;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,故F为Cu;(1)A的基态原子最外层有4个电子,故有四种不同的运动状态;F为Cu,位于ds区;(2)E为Mn,失去4s层两个电子,故核外电子排布为1s2 2s2 2p6 3s2 3p6 3d5;AD4为CCl4,非极性化合物;(3)C、N、O三者的电负性大小为C < N< O;因N原子2p轨道半充满,故较难失去一个电子,因此比O原子稳定;AC2为CO2,等电子体为N2O;BD3为NCl3,中心原子采用sp3杂化,分子结构为三角锥形;(4)配位数为12个,以最上面中心为例,同一层上四个角,加上下面4个面中心四个,和上面4个面对应的4个,总共12个;设F原子的半径为r cm,晶胞的边长为a cm,则可以得到a=2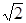 r,根据m=ρν=nM可得:ρg/cm3×a3 cm3=4÷NA×64g/mol,将a=2
r,根据m=ρν=nM可得:ρg/cm3×a3 cm3=4÷NA×64g/mol,将a=2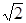 r代入可求得:r=
r代入可求得:r=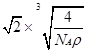 ×1010
×1010
点评:物质的结构是高考历年的重点,考生在备考中要注意区分各概念,熟练运用概念进行相关的判断。理论性强,难度较大。
本题难度:困难
3、选择题 下列化学用语正确的是
[? ]
A.甲烷的球棍模型: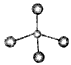
B.乙醇的分子式:CH3CH2OH
C.有18个中子的过氧化氢分子:T2O2
D.羟基的电子式: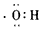
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
[? ]
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
参考答案:D
本题解析:
本题难度:简单
5、选择题 关于晶体的下列说法正确的是
[? ]
A.晶体中只要有阳离子,就一定有阴离子
B.晶体中只要有阴离子,就一定有阳离子
C.氢键具有方向性和饱和性,也属于一种化学键
D.金属键由于无法描述其键长、键角,故不属于化学键
参考答案:B
本题解析:
本题难度:简单