微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某酸性溶液中可能含有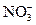 、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
A.一定含I-
B.不含Fe3+
C.一定含Cl-
D.不含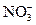
参考答案:C
本题解析:溴水褪色,一定含I-,Fe3+、NO-3(H+)不能与I-共存,一定无Fe3+、NO-3,Cl-不能确定。
本题难度:简单
2、简答题 在如右图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有铜片和浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
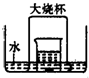 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
①______;②______;
③______;④______;
(2)欲使反应更快进行,应向小烧杯中加入______(填“粗铜片”或“纯铜片”),其原因是______.
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是______.
(4)若要验证最终得到的气体中是否有NO,最简便的方法是______.若实验证明最终得到的气体中无NO,则实验结束后大烧杯中液面的变化情况是______.
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液.欲使NO和NO2被充分吸收,则NO和NO2的体积应满足______.
(NO+NO2+2NaOH=2NaNO2+H2O)
a.V(NO)>V(NO2)b.V(NO)<V(NO2)c.V(NO)≤V(NO2)
参考答案:(1)铜与浓硝酸反应生成硝酸铜和红棕色的二氧化氮气体,同业颜色为蓝色,二氧化氮气体可与水反应生成无色的一氧化氮和硝酸,
故答案为:①铜片表面产生气泡,铜片慢慢溶解;②小烧杯中溶液的颜色逐渐变成蓝色;③大烧杯中有红棕色气体生成,后来慢慢变成无色;
(2)粗铜含有其它金属或非金属,在溶液中可形成原电池反应,反应速率增大,故答案为:粗铜片;粗铜片在反应中可形成原电池,加速反应的进行;
(3)因Cu与浓HNO3反应生成的NO2和间接得到的NO,都是污染性气体,必须有尾气吸收装置,对比传统实验,所以该装置最突出的优点是:没有尾气处理装置,却无氮氧化合物逸出,不污染环境,
故答案为:反应体系封闭,无氮氧化物逸出,不污染环境;
(4)一氧化氮与氧气反应生成二氧化氮,颜色变为红棕色,可轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体,若实验证明最终得到的气体中无NO,二氧化氮与水反应生成硝酸和一氧化氮,压强减小,则实验结束后大烧杯中液面上升,
故答案为:轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体;液面上升;
(5)因2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,观察两个方程式,则只要NO2气体比NO多,则混合气体就能够被NaOH溶液完全吸收,所以V(NO2):V(NO)≥1,故答案为:C.
本题解析:
本题难度:一般
3、选择题 下列所选用试剂(仪器自选)能达到实验目的是( )
A.探究同周期非金属元素性质递变规律:氯水、溴化钾、碘化钾、四氯化碳
B.探究+4价硫既有氧化性又有还原性:亚硫酸钠溶液、溴水、酸性高锰酸钾溶液、盐酸
C.探究SO2和Cl2漂白原理不同:含酚酞的氢氧化钠溶液
D.探究氨气具有还原性:碳酸氢铵、碱石灰、氧化铜、无水硫酸铜
参考答案:A.氯溴碘为同主族元素,利用氯水、溴化钾等试剂,不能探究同周期非金属元素性质递变规律,故A错误;
B.溴水、酸性高锰酸钾溶液都是强氧化性物质,能证明+4价硫具有还原性,但具有还原性的盐酸,不能与亚硫酸钠发生氧化还原反应,所以B组试剂只能证明+4价硫具有还原性,不能探究它是否有氧化性,故B错误;
C.氯气溶于水生成的次氯酸具有永久漂白性,能使含酚酞的氢氧化钠溶液褪色,而二氧化硫和氢氧化钠反应生成亚硫酸钠和水,碱性减弱褪色,无法区别,应选品红试液完成实验,故C错误;
D.碳酸氢铵分解生成氨气、二氧化碳、水,用碱石灰吸收二氧化碳和水,加热条件下,干燥的氨气与氧化铜反应,用无水硫酸铜检验产物中是否有水,能达到实验目的,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 (10分)(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
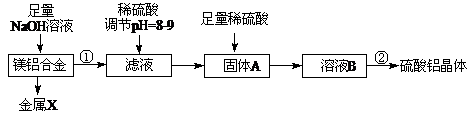
则镁铝合金中加NaOH溶液的化学反应方程式为?▲?,
金属X是?▲?,固体A的化学式?▲?,操作②包含的步骤有蒸发浓缩、?▲?、过滤、干燥。
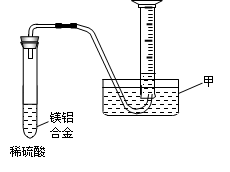
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称?▲?,需要测定的数据有?▲?。
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
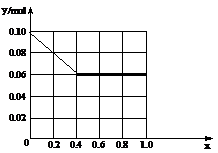
的物质的量之和为0.10 mol,若向此溶液加入170 mL? 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为?▲?mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。?
参考答案:(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑, Mg, Al(OH)3 ,冷却结晶(降温结晶)(4分)(2)水槽 ,氢气的体积、镁铝合金的质量(温度、大气压强)答(到前2个条件给满分)。
(1+2分,共3分)
(3)0.06mol?如图(1+2分,共3分)
本题解析:略
本题难度:一般
5、选择题 只用一种试剂,一次区别开Na2SO4、AgNO3?和Na2CO3三种溶液,该试剂是( )
A.BaCl2溶液
B.KOH溶液
C.NaNO3溶液
D.稀盐酸
参考答案:A.BaCl2溶液与Na2SO4、AgNO3?和Na2CO3三种溶液反应均生成白色沉淀,现象相同,无法区别,故A错误;
B.KOH溶液与Na2SO4、Na2CO3两种溶液均不反应,无法区别,故B错误;
C.NaNO3溶液与Na2SO4、AgNO3?和Na2CO3三种溶液均不反应,无法区分,故C错误;
D.稀盐酸与Na2SO4不反应,稀盐酸与AgNO3反应生成白色沉淀,稀盐酸与Na2CO3反应生成气体,现象不同,能区别,故D正确;
故选D.
本题解析:
本题难度:简单