微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用18 mol/L H2SO4配制100 mL 1.0mol/L H2SO4,若实验仪器有A.100m L 量筒? B.托盘天平? C.玻璃棒? D.50m L容量瓶? E.10m L量筒? F.胶头滴管? G.50m L烧杯? H.100m L 容量瓶
(Ⅰ)实验时选用的仪器有(填序号)________________________配制过程中,下列情况会使配制结果偏高的是(填序号)_______。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)_______________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再 用待配液润洗
用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
2、选择题 下列实验能达到目的的是?(?)
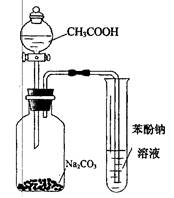
A.分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡
C.检验Fe2O3中是杏含有FeO,用盐酸溶解样品后,滴加高锰酸钾溶液,观察溶液紫色是否褪色或变浅
D.利用图示装置并根据有关实验现象能推知酸性: CH3COOH>H2CO3>C6H2OH
3、实验题 (16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:

已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2
B.NaOH
C.Na2SO4
D.HCl
