微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 “卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
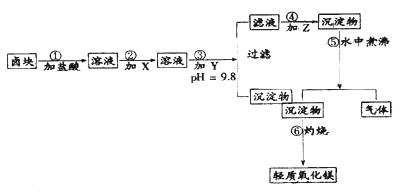
轻质氧化镁生产工艺流程图
表1?生成氢氧化物沉淀的PH值
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
Fe(OH)2
Mn(OH)2
Mg(OH)2
| 2.7
7.6
8.3
9.6
| 3.7
9.6
9.8
11.1
|
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2?化学试剂价值表
试剂
| 价格(元/t)
|
漂液(含NaClO25.2%)
H2O2(30%)
NaOH(固98%)
Na2CO3(固99.5%)
卤块(MgCl2,30%)
| 450
2400
2100
600
310
|
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是??,其作用是??。
(2)步骤③加入的试剂Y应是??;之所以要控制pH=9.8,其目的是??。
(3)在步骤⑤时发生的化学反应方程式是:??
参考答案:(l)漂液,使Fe2+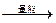 Fe3+
Fe3+
(2)NaOH使杂质离子(Fe3+、Mn2+)沉淀完全又尽量减少Mg2+损失
(3)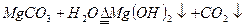
本题解析:在题目第一段阅读中要明确试题要求:(1)由卤块(含杂质的MgCl2)制得“轻质氧化镁”(不含杂质Fe2+、Fe3+、Mn2+离子)(2)成本较低。在阅读观察工艺流程图要明确:(3)杂质离子在步骤③加入Y(NaOH)强调PH=9.8除(成为 Fe(OH)3、Mn(OH)2沉淀)(4)步骤④、⑤、⑥是由MgCl2(含Na+)到轻质氧化镁的转化、制备过程。(3)通过逆向思维:MgO Mg(OH)2
Mg(OH)2 MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
在阅读附表1时需结合试题分析(5)在步骤②需加氧化剂使Fe2+转化为Fe3+以便沉淀完全容易除去。(6)步骤③控制PH=9.8是为了使Mn(OH)2沉淀完全,虽然Mg(OH)2已开始沉淀会影响产率,但保证了产品纯度,且原料卤块价格比较低廉。(7)在阅读附表2时可以从成本较低的角度考虑步骤②
本题结合工业生产实际考查无机化合物(轻质氧化镁)的转化生成、分离、提纯问题。涉及了金属元素(Mg、Fe、Mn)及其化合物相互转化的知识和信息加工、迁移能力,逻辑推理和逆向思维能力。
本题难度:一般
2、实验题 某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
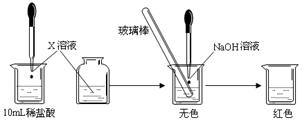
则X溶液是? ▲?。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
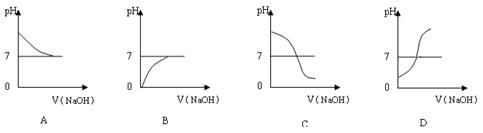
①写出测定溶液pH值的操作方法:? ▲?;
②上图中哪个图像符合该同学的记录? ▲?(填序号)。
(3)你认为甲、乙两位同学的实验中,? ▲?(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:? ▲?。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
滴定次数
| 盐酸的体积/mL
| ? NaOH溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
? 1
| 25.00
| ? 2.00
| 20.20
|
? 2
| 25.00
| ?1.02
| 21.03
|
? 3
| 25.00
| ?0.20
| 20.20
|
(1) 根据以上数据计算出盐酸的物质的量浓度为? ▲?mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。? ▲?。
参考答案:(12分)
Ⅰ.(1)酚酞(2分)
(2)①用干净的玻璃棒蘸取待测液点在pH试纸中间,将试纸的颜色与标准比色卡对照,读出溶液的pH(2分)?② D?(1分)
(3)乙同学(1分)
甲同学的实验有可能是酚酞遇氢氧化钠溶液直接变成红色,乙同学的实验,随着滴加氢氧化钠溶液,溶液的pH由小于7逐渐增大到7,这充分证明溶液中的盐酸因反应而消耗了(2分)。
Ⅱ:(1) 0.080(2分)(若0.08也给分)
(2)用上述未知浓度的盐酸进行反滴,记录所需盐酸的体积(2分)。
本题解析:略
本题难度:简单
3、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
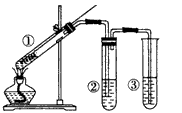
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
4、实验题 一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制取一氯甲烷:
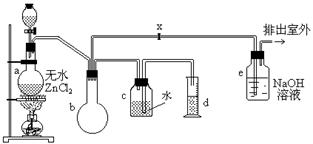
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式?,
(2)装置b的作用是?;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为
?;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是?;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是?;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是?;
(7)实验结束后,d中收集到的液体中含有?。
参考答案:(1)CH3OH+HCl CH3Cl+H2O?
CH3Cl+H2O?
(2)防止倒吸,保证安全?(3)NaOH+HCl=NaCl+H2O?
(4)2CH3Cl+3O2 2CO2+2H2O+2HCl?
2CO2+2H2O+2HCl?
(5)可使甲醇充分反应,转化成一氯甲烷?
(6)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出?
(7)甲醇、盐酸、一氯甲烷
本题解析:(1)在催化剂的作用下,甲醇和氯化氢发生取代反应生成一氯甲烷,反应的化学方程式使CH3OH+HCl CH3Cl+H2O。
CH3Cl+H2O。
(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全。
(3)卤代烃能发生碱性水解,转化为醇。由于在生成醇的同时,还生成氯化氢,则装置e中可能发生的反应方程式为NaOH+HCl=NaCl+H2O。
(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢,则CH3Cl燃烧的化学方程式是2CH3Cl+3O2 2CO2+2H2O+2HCl。
2CO2+2H2O+2HCl。
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应,显然盐酸是过量的,因此可以提高甲醇的转化率,使甲醇充分反应,转化成一氯甲烷。
(6)根据已知条件可知,甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,所以收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多。
(7)由于甲醇和盐酸都是易挥发的,因此实验结束后,d中收集到的液体中含有甲醇、盐酸、一氯甲烷。
点评:该题是高考中的常见题型,属于中等难度的试题。该题综合性强,侧重对学生实验能力的培养,提高学生的学科素养。有利于培养学生规范、严谨的实验设计、评价能力以及操作动手能力。该题需要明确的这种类型的试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
5、实验题 (10分)某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
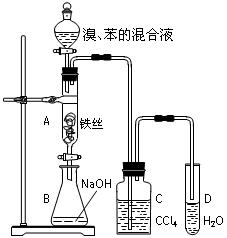
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
?
| 向试管D中加入的试剂
| 能证明苯与液溴发生取代反应的现象
|
方法一
| ?
| ?
|
方法二
| ?
| ?
参考答案:(10分)(1)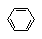 +Br2 +Br2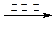 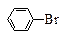 +HBr +HBr
(2)除去溶于溴苯中的溴?
(3)除去溴化氢气体中的溴蒸气
(4)方法一:AgNO3溶液?产生(淡黄色)沉淀
方法二:石蕊试液?溶液变红色(或其他合理答案)
(除第⑷小题每空1分,其余每空2分,共10分)
本题解析:略
本题难度:简单
|