微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
①盐酸是一种既有氧化性,又有还原性的强酸;②向淀粉碘化钾溶液中通入一种气体时,如果溶液变蓝,则通入的气体一定是氯气;③漂白粉在空气中长期放置会变质,是由于被氧气氧化的缘故;④金属氧化物与盐酸的化学反应都是复分解反应;⑤在氧化还原反应中,还原剂得到的电子总数与氧化剂失去的电子总数一定相等。
A.全部
B.①
C.①②③④
D.①⑤
参考答案:D
本题解析:略
本题难度:一般
2、选择题 分类法是化学学习中的一种重要方法,下列分类图正确的是
[? ]
A.
B.
C.
D.
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列变化中,需加氧化剂才能实现的是
A.NaClO →NaCl
B.FeCl3 →FeCl2
C.C → CO2
D.CaO→Ca(OH)2
参考答案:C
本题解析:
正确答案:C
A.NaClO →NaCl ,Cl化合价降低,加还原剂? B.FeCl3 →FeCl2?铁化合价降低,加还原剂? C.C → CO2?化合价升高,加氧化剂? D.CaO→Ca(OH)2,元素化合价均不变,需要加氧化剂、还原剂。
本题难度:简单
4、填空题 (6分)二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式?。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是?。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平)
Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?。
参考答案:6分)(1)Se+2HNO3(浓)==H2SeO3+NO↑+NO2↑
或Se+2HNO3(浓)="=" SeO2+NO↑+NO2↑+H2O(2分)
(2)H2SO4(浓)> SeO2> SO2?(2分)?(3)0.925(2分)
本题解析:利用题中信息可知Se和浓HNO3反应,Se被氧化成+4价的H2SeO3,HNO3被还原为NO和NO2,利用电子守恒和题中限定条件(Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1)可知方程式:Se+2HNO3(浓)==H2SeO3+NO↑+NO2↑。利用氧化性:氧化剂>氧化产物,结合方程式可得出:SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> SO2,
(3)可以化合价升降法配平,即Se由+4降至0价,化合价变化单位为4,I由—1升至0价,化合价变化单位为1,根据化合价变化总数相等,则KI的系数为4,SeO2系数为1,然后配平其它原子,在反应1中I-失去电子,SeO2得到电子。根据方程式:
第一个反应方程式得SeO2---2I2
再结合第二个方程式,可知SeO2---2I2---4Na2S2O3
1? 4
X? 0.2000 mol/L×0.025 L
x= 1/4×0.2000 mol/L×0.025 L
m(SeO2)= 1/4×0.2000 mol/L×0.025 L×111 g/mol
即样品中SeO2质量分数为m/0.1500 =0.925
点评:熟练掌握氧化还原反应的相关概念和计算。理解电子守恒法在计算中应用。
本题难度:一般
5、填空题 某反应中反应物与生成物有: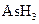 、
、 、
、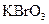 、
、 、
、 、
、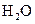 和一种未知物质X。
和一种未知物质X。

 (1)已知
(1)已知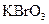 在反应中得到电子,则该反应的还原剂是?。
在反应中得到电子,则该反应的还原剂是?。
 (2)已知0.2mol
(2)已知0.2mol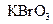 在反应中得到1mol电子生成X,则X的化学式为?。
在反应中得到1mol电子生成X,则X的化学式为?。
 (3)根据上述反应可推知?。
(3)根据上述反应可推知?。
 ? a.氧化性:
? a.氧化性: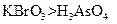 ? b.氧化性:
? b.氧化性: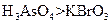
 ? c.还原性:
? c.还原性: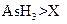 ? d.还原性:
? d.还原性: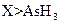
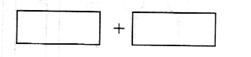
 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
 向和数目:
向和数目:
参考答案:
 (1)AsH3
(1)AsH3
 (2)Br2
(2)Br2
 (3)ac
(3)ac
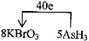
 (4)?
(4)?
本题解析:(1)KBrO3在反应中得到电子,则另外一种化合价变化的元素在反应中失去电子被氧化,所给物质中As元素化合价发生了变化,低价态的AsH3是还原剂。
(2)0.2mol KBrO3得到1mol电子,说明Br元素在反应中降低了5价,所以x的化学式为Br2。
(4)利用氧化还原反应中电子得失相等的规律可配平该方程式为
8KBrO3+5AsH3+4H2SO4===4K2SO4+4Br2+5H3AsO4+4H2O
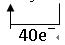

本题难度:一般