微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知一种c(H+)=1×10—3mol/L的酸溶液和一种c(OH—)=1×10—3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.碱过量,没有全部参加反应
B.等浓度的一元强酸和一元弱碱溶液反应
C.等浓度的一元弱酸和一元强碱混合
D.浓的弱酸和稀的强碱溶液反应
参考答案:D
本题解析:c(H+)=1×10—3mol/L的酸溶液和一种c(OH—)=1×10—3mol/L的碱溶液等体积混合后溶液呈酸性,即可得该酸为弱酸,酸过量导致溶液显酸性,所以,正确选项为D;
本题难度:简单
2、选择题 今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为V L;③pH=2的硫酸;④pH=12的氢氧化钠溶液。下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1)
B.V1L③溶液和V2L④溶液混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④两溶液等体积混合,混合液pH=7
D.①与③两溶液的物质的量浓度相等
参考答案:B
本题解析:溶液用蒸馏水稀释,使体积扩大10倍,溶液中氢离子的浓度减小,溶液的PH增大,A错误;③和④是强酸和强碱溶液,根据混合后溶液pH=3可以得到混合后溶液中H+的浓度为10-3mol/L,所以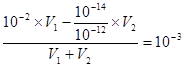 计算得V1:V2=11:9,所以B正确;由于醋酸是弱酸,溶液中还存在醋酸分子所以①与④两溶液等体积混合,混合液pH小于7,C错误;硫酸属于二元强酸,醋酸属于弱酸当PH相同时,二者的浓度不同,D错误;所以答案选B。
计算得V1:V2=11:9,所以B正确;由于醋酸是弱酸,溶液中还存在醋酸分子所以①与④两溶液等体积混合,混合液pH小于7,C错误;硫酸属于二元强酸,醋酸属于弱酸当PH相同时,二者的浓度不同,D错误;所以答案选B。
本题难度:一般
3、填空题 (12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。
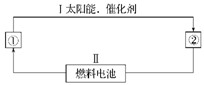
(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
参考答案:(12分)
(1)①H2O? ②H2和O2 ?化学? 电
(2)①CH4? ②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
③802 ?④4H2O+2O2+8e-===8OH-
本题解析:(1)水在太阳能作用下分解为氢气和氧气,而氢气和氧气通过发生原电池反应产生电能,同时生成水。
(2)①由题意很容易可知A的式量为16,属于烃,也只能为甲烷;
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
③H2O(l)= H2O(g)?ΔH=+44 kJ/mol,将③+2×②,可得:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ/mol
④氧气得电子生成氢氧根离子:4H2O+2O2+8e-===8OH-
本题难度:一般
4、选择题 在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A.11.52
B.11.70
C.11.82
D.12.00
参考答案:D
本题解析:混合后氢氧根浓度是(0.4*0.1-0.1*2*0.1)/0.2=0.1mol/L,pH为13-1=12。故选D。
点评:本题考查的是PH的计算,先分析出溶液H+和OH-的浓度,计算出哪个离子多,确定溶液最终呈酸性或碱性,再进行PH的计算。
本题难度:简单
5、填空题 酸是化学中重要的一类物质,人们对酸的认识是逐步加深的。
⑴ 1887年,阿仑尼乌斯提出了电离理论,在水溶液中能电离出H+的为酸,电离出OH?离子的为碱。比较水溶液中,下列阴离子的共扼酸的酸性大小_____________________(填序号)

⑵ 1905年,弗兰克提出了溶剂酸碱理论。该理论认为凡是在溶剂中产生该溶剂的特征阳离子的溶质叫酸,产生该溶剂的特征阴离子的溶质叫碱。试判断液NH3中加入Li3N后酸碱性变化情况,并结合方程式解释
⑶ 1923年布朗斯特提出了质子理论。认为凡是能够给出质子的物质都为酸,接受质子的物质为碱。有电子总数相同的三种微粒,它们既是质子酸又是质子碱,且分别为阴离子、中性分子和阳离子,它们是__________________________
⑷ 质子理论提出的同年,路易斯提出了电子理论,凡是接受电子对的为酸,给出电子对的为碱。NH3和NF3的均为路易斯碱, 碱性更强的是_____?__ ,
理由是____________?_______
⑸ 1966年第一个超强酸被偶然发现,通常由质子酸和路易斯酸混合。用SbF5与氟磺酸反应后,可得到一种超强酸H[SbF5(OSO2F)]。写出该超强酸在氟磺酸中的电离方程式。
参考答案:⑴ (2)>(3)>(1)?(2分)
⑵ 碱性增加,2NH3 ?NH4+ ?+ NH2—?
?NH4+ ?+ NH2—?
NH3 + N3- = HN2- + NH2-或2NH3 + N3- = 3NH2-(2分)
⑶ HS-,H2O2,N2H5+?(全对给2分,其他合理结论也给分)
⑷ NH3? F的吸电子能力强,使N上电子云密度降低(2分,各1分)
⑸ H[SbF5(OSO2F)]+HSO3F = H2SO3F++ [SbF5(OSO2F)]-?(2分)
本题解析:⑴ 共轭酸酸性的强弱,可以从共轭碱的稳定性来判断,共轭碱越稳定,其共轭酸的酸性越强,反之越弱。在-O=的对位,-NO2是吸电子基团,能使-O-的负电荷分散,因而稳定性增强,所以⑵的共轭酸的酸性最强;-OCH3是推电子基团,不利于-O-负电荷的分散,因此该共轭碱最不稳定,所以⑴的共轭酸的酸性最弱。
综上所述,共轭酸的大小顺序为⑵>⑶>⑴。
⑵ 根据溶剂理论,在NH3(l)中,NH2-是最强的碱,由于Li3N的碱性比LiNH2的碱性还要强,因此在NH3(l)中,会发生拉平效应,从而使液NH3的碱性增强。这个过程相当于在水溶液中,最强的碱是OH-,比OH-强的碱都会发生水解,生成OH-,同时水溶液的碱性增强。
⑶ 既是质子酸,又是质子碱,这类物质在质子理论中又称为两性物质。比如H2O就是最简单的两性分子,HCO3-是最常见的两性阴离子。但是题目中要求的是电子数相同的三种微粒,在10电子物质中,不可能同时存在这些微粒,因此要考虑18e-微粒。两性分子为H2O2,阴离子为HS-——这两种微粒显而易见,阳离子可以为质子化的N2H4。其实此题最关键的是掌握高中阶段要求同学们掌握的10e-、18e-结构的微粒。
⑷ 质子酸和路易斯酸形成的超酸是众多超酸中的一种,它是由质子酸电离后生成的酸根离子作为配体与路易斯酸形成稳定的配位化合物,从而使混合物的酸性增强。。在本题中,SbF5是路易斯酸(因为Sb有空的轨道),HSO3F是质子酸(HSO3F FSO3-+H+),所以FSO3-以氧原子作为配体与SbF5的Sb形成配位键,即[SbF5(OSO2F)]-。由于该酸的酸性比HSO3F的酸性还要强,因此,该超酸在氟磺酸中提供质子,变成了[SbF5(OSO2F)]-,氟磺酸得质子,形成H2SO3F+。
FSO3-+H+),所以FSO3-以氧原子作为配体与SbF5的Sb形成配位键,即[SbF5(OSO2F)]-。由于该酸的酸性比HSO3F的酸性还要强,因此,该超酸在氟磺酸中提供质子,变成了[SbF5(OSO2F)]-,氟磺酸得质子,形成H2SO3F+。
本题难度:一般