微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
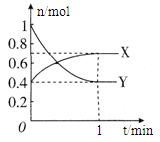
(1)曲线??(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正)??,v(逆)??。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则?中反应更快。
(4)在0到1 min中内用X表示该反应的速率是?,该反应达限度时,Y的转化率?,反应开始时与反应达平衡状态时的压强之比为?。
参考答案:

本题解析:(1)由方程式N2O4(g)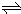 2NO2?(g),可知反应中NO2?的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2?(g),可知反应中NO2?的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=0.3mol?L-1?min-1,乙中v?(N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?min-1,
则乙反应较快,故答案为:乙;
(4)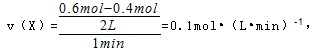
该反应达最大限度时,Y的转化率为:
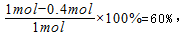
开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,
平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,
在相同条件下,气体的压强之比等于物质的量之比,
则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,
故答案为:0.1mol?(L?min)-1;60%;14:11;。
本题难度:一般
2、选择题 mA(g)+nB(g)  pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图2-32中实线所示,有关叙述正确的是?(?)
pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图2-32中实线所示,有关叙述正确的是?(?)
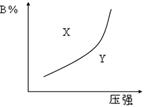
A.m+n> p
B.x点的速率关系为v正>v逆
C.n>p
D.x点比y点混合物反应速率快
参考答案:B
本题解析:略
本题难度:简单
3、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______________。
(2)反应开始至2min,以气体Z表示的平均反应速率为____________。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_________倍。
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时___________(填“增大”“减小”或“相等”)。
参考答案:(1)3X+Y  2Z?
2Z?
(2)0.05mol/(L·min)
(3)①0.9;②增大
本题解析:
本题难度:一般
4、填空题 在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g)?ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g)?ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
时间min
| 0
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
|
n(SO2)
| 2.00
| 1.92
| 1.84
| 1.76
| 1.76
| 1.64
| 1.52
| 1.40
| 1.40
| 1.40
|
n(O2)
| 1.00
| 0.96
| 0.92
| 0.88
| 0.88
| 0.82
| 0.76
| 0.70
| 0.70
| 0.70
|
n(SO3)
| 0
| 0.08
| 0.16
| 0.24
| 0.24
| 0.36
| 0.48
| 0.60
| 0.60
| 0.60
|
?
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。
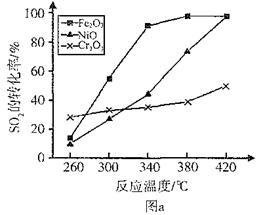
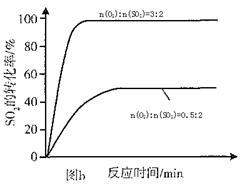
(4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。
参考答案:(1)3~4min(2分)? 7~9min(2分)(2)增大压强(2分);正(2分)?
(3)Cr2O3? (2分) Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率。(2分)
(4)(3分)(标注1分,转折点1分,平台1分)
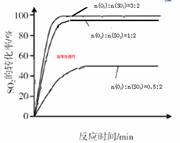
本题解析:(1)由表格中的数据分析知,3~4min和7~9min时SO2、O2、SO3的物质的量保持不变,为化学平衡状态;(2)从表中数据分析,第5min时,SO2和O2的物质的量减小,SO3的物质的量增大,说明平衡向正向移动,该反应为放热反应,改变的条件可能为增大压强或降低温度,而降温反应速率变慢,从同时提高速率和转化率两个方面分析,改变的外界条件只能是增大压强;(3)由图像可知,当其他条件相同时,2600C以Cr2O3作催化剂,SO2的转化率最大,反应速率最快;对比分别以Fe2O3和NiO作催化剂的图像知,以Fe2O3作催化剂时,能在较低的温度下使SO2达到较高的转化率,因此选择Fe2O3;(4)分析图像b知,当SO2的物质的量相同时,O2的物质的量越大,达平衡的时间越短,反应速率越快,SO2的平衡转化率越大,以此可画出n(O2):n(SO2)=1:2时SO2转化率的预期变化曲线。
本题难度:一般
5、选择题 在一密闭容器中,反应 aA(g)  ?bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
?bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
A.平衡向正反应方向移动
B.a>(b+c)
C.物质B的质量分数增大
D.以上判断都错误
参考答案:D
本题解析:反应 aA(g)  bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,若平衡不发生移动,则由于体系的体积是原来的2倍,所以浓度是原来的一半,现在最终测得A的物质的量的浓度变为原来的50%,所以该反应为反应前后气体的体积相等的反应。改变压强化学平衡不发生移动,a=(b+c)。反应体系中任何物质的浓度由于平衡未发生移动,都不变。因此选项中的各种说法都错误。选项为D。
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,若平衡不发生移动,则由于体系的体积是原来的2倍,所以浓度是原来的一半,现在最终测得A的物质的量的浓度变为原来的50%,所以该反应为反应前后气体的体积相等的反应。改变压强化学平衡不发生移动,a=(b+c)。反应体系中任何物质的浓度由于平衡未发生移动,都不变。因此选项中的各种说法都错误。选项为D。
本题难度:一般