微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下将N2和H2充入一恒容的密闭容器中,发生可逆反应:N2+ 3H2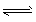 2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是?
2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是?
[? ]
A.v(N2)= 0.01 mol/(L·s),v(H2)= 0.02 mol/(L·s)
B.v(H2)= 0.02 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
C.v(N2)= 0.01 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
D.v(H2)= 0.06 mol/(L·s) ,v(NH3)= 0.4 mol/(L·min)
参考答案:C
本题解析:
本题难度:一般
2、选择题 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)? 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件,平衡图像如下,则下列说法正确的是
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.t0时改变的条件是增压
参考答案:A
本题解析:略
本题难度:一般
3、填空题 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
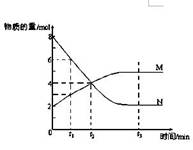
(1)该反应的化学方程式是_____________?______。
(2)在图上所示的三个时刻中,?(填t1、t2或t3)时刻处于平衡状态,此时V正?V逆(填>、<或=);达到平衡状态后,平均反应速率v(N)﹕v(M)= ?。
(3)若反应容器的容积不变,则压强不再改变?(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率??
A.升高温度
B.降低压强
C.减小M的浓度
D.将反应容器体积缩小
参考答案:(1)2N M (2)t3 ?=?2﹕1?(3)能?(4)AD
M (2)t3 ?=?2﹕1?(3)能?(4)AD
本题解析:(1)根据图像可知,反应进行到t2时,N的物质的量减少8mol-4mol=4mol,M的物质的量增加4mol-2mol=2mol,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的化学方程式是2N M。
M。
(2)根据图像可判断,t1、t2时物质的浓度还是再变化的,反应没有达到平衡状态。而t3时物质的浓度不再发生变化,反应达到平衡状态,因此此时V正=V逆。由于反应速率之比是相应的化学计量数之比,所以达到平衡状态后,平均反应速率v(N)﹕v(M)=2︰1。
(3)根据反应的化学方程式可知,该反应是体积减小的,所以在反应过程中,压强也是减小,则当压强不再发生变化时,可以说明反应达到平衡状态。
(4)升高温度或最大压强都可以加快反应速率,因此选项AD正确,B和C是降低反应速率的,答案选AD。
点评:该题属于中等难度的试题,基础性强。考查学生对基础知识的掌握程度以及运用基础知识解决实际问题的能力。
本题难度:一般
4、填空题 (5分)在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l) 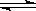 ?4NH3(g)+3O2(g) △H =" a" kJ.mol-1
?4NH3(g)+3O2(g) △H =" a" kJ.mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
温度T/K
| 303
| 313
| 323
|
NH3生成量/(10—6mol)
| 4.8
| 5.9
| 6.0
|
①该反应的a______0(填“>”、“<”或“=”)(2分)
②已知:N2(g)+3H2( g)
g) 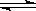 3NH3(g) △H =" —92.4" kJ.mol-1
3NH3(g) △H =" —92.4" kJ.mol-1
2H2(g) + O2(g)==2H2O(l)?△H =" —571.6" kJ.mol-1
则 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l)  ?4NH3(g) + 3O2(g)△H = _________。(3分)
?4NH3(g) + 3O2(g)△H = _________。(3分)
参考答案:①>?②1530.0 kJ.mol-1
本题解析:略
本题难度:一般
5、简答题 【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
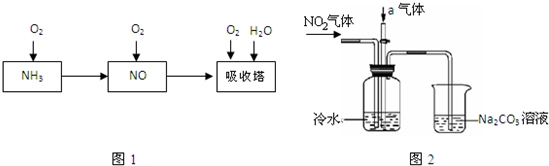
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是?;
(2)连接好装置后,首先进行的操作是?;
(3)通入a气体的目的是?;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是?。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是?;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K=?,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为?。
N2O4(g)的平衡常数K=?,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为?。
参考答案:(1)4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)检验装置的气密性
(3)提高NO2的转化率
(4)2NO2+Na2CO3═NaNO2+NaNO3+CO2
(4)2N2O4+O2+2H2O=4HNO3
(6)1/2? 50%
本题解析:(1)氨气的催化氧化反应方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验。
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率。
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,其反应方程为2NO2+Na2CO3═NaNO2+NaNO3+CO2
(5)根据元素守恒和得失电子守恒分析,N2O4与水和氧气反应生成硝酸,反应方程式为:2N2O4+O2+2H2O=4HNO3
(6)根据平衡常数表达式计算,K= c(N2O4)/ c2(NO2)=1/2,设反应的NO2为xmol/L
2NO2(g) N2O4(g)
N2O4(g)
起始浓度:? 2mol/L? 0
反应浓度:? x ? 1/2 x
平衡浓度:?2-x ?1/2 x
 ? X=1? NO2的最大转化率=1/2×100%=50%
? X=1? NO2的最大转化率=1/2×100%=50%
本题难度:一般