微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Na2O2投入三氯化铁溶液中,可观察到的实验现象是
A.生成白色沉淀
B.生成红褐色沉淀,且有气泡产生
C.生成白色沉淀,迅速变成灰绿色,最后变成红褐色
D.无变化
参考答案:B
本题解析:过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和三氯化铁溶液反应得到氢氧化铁红褐色沉淀。所以,观察到的现象是生成红褐色沉淀,且有气泡产生,选B 。
本题难度:简单
2、填空题 混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此判断:
(1)固体B所含物质的化学式为______.
(2)固体E所含物质的化学式为______.
(3)反应①的离子方程式为______.
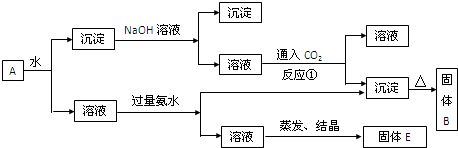
参考答案:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
(1)、向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量),Al(OH)3受热分解2Al(OH)3?△?.?Al2O3+3H2O,生成Al2O3;
故答案为:Al2O3?
(2)、向溶液中加过量氨水,溶液与过量氨水反应,Al3++3NH3.H2O=3NH4++Al(OH)3↓,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4?和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4?和(NH4)2SO4.
故答案为:K2SO4;(NH4)2SO4?
(3)、向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和Na2CO3(或者NaHCO3,取决于CO2的量)
反应①CO2不足时,生成Al(OH)3沉淀和碳酸钠,离子方程式为:2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓;
CO2过量时,生成Al(OH)3沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
故答案为:2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓或AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
本题解析:
本题难度:一般
3、计算题 铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s)?△H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g)?△H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H=?kJ·mol-1。
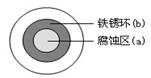
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是?区(填“正极”或“负极”),其电极反应式为?。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③?。
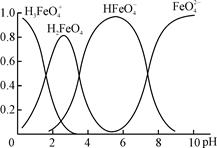
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是?。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为?。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁??g。
参考答案:(1)+489.0
(2)正极? O2+2H2O+4e-=4OH-
(3)2Fe3++Fe=3 Fe2+
(4)①AB?②4FeO+10H2O=4Fe(OH)3+8OH-+3O2↑
(5)2.8 g
本题解析: (1)由盖斯定律得,△H="-110.5" kJ·mol-1×3-[(-1642 kJ·mol-1)÷2]= +489.0kJ·mol-1。(2)铁发生吸氧腐蚀,液滴边缘电极反应式为O2+2H2O+4e-=4OH-,液滴边缘为正极区。(3)加入的Fe与Fe3+生成Fe2+。(4)pH为2时,铁元素有三种存在形态,pH为4、6、8时,铁元素有两种存在形态,A错误;向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数先增大后减小,B错误;pH=6的这种溶液中加KOH溶液,FeO分布分数增大,HFeO分布分数减小,离子方程式为HFeO+OH-=FeO+H2O,C正确。(5)混合物中加盐酸后,再加KSCN溶液不显红色说明溶液中溶质为FeCl2,Fe与Cl物质的量比为1:2,Cl来自盐酸,物质的量为0.1mol,所以Fe元素物质的量为0.05mol,用CO还原同质量的混合物得到铁物质的量亦为0.05mol,质量为2.8g。
本题难度:困难
4、选择题 、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是……( )
A.硫酸
B.碘水
C.硝酸锌
D.氯化铜
参考答案:C
本题解析:Fe溶于过量盐酸生成Fe2+,再加入Zn(NO3)2,在酸性条件下相当于加入了强氧化性的硝酸,则Fe2+被氧化成了Fe3+,而碘、较稀的硫酸和铜离子的氧化性均比Fe3+弱,不能氧化Fe2+。
本题难度:一般
5、简答题 (14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
操?作
| 现?象
|
通入氯气至过量

| I.A中溶液变红
II.稍后,溶液由红色变为黄色
|
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 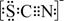 。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。?
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
参考答案:(14分)
(1)Cl2+2OH— ="==" Cl—+ClO—+ H2O
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN—反应生成红色的,所以溶液变红
(3)①Fe3+?
(4)①SCN—中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN—中氮元素被氧化成
④16
本题解析:(1)B中是氯气与氢氧化钠的反应,离子方程式为Cl2+2 OH-= Cl-+ ClO-+ H2O;
(2)A中的Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色Fe(SCN)3,所以溶液变红
(3)①加入NaOH溶液,有红褐色沉淀生成,此红褐色沉淀为氢氧化铁沉淀,则溶液中一定存在Fe3+
(4)①因为SCN—中碳元素已经是最高价态+4价;
②与盐酸酸化的BaCl2溶液,产生白色沉淀,此白色沉淀为硫酸钡沉淀,所以被氧化的元素是硫元素;
③证明SCN—中氮元素转化为NO3-,利用硝酸的强氧化性,被还原的产物是红棕色气体,可证明SCN—中氮元素转化为NO3-,
④SCN—与Cl2反应生成1 mol CO2,说明有1mol的SCN—与Cl2反应,SCN—中的-2价S、-3价N化合价升高到+6价、+5价,失电子总数为8+8=16mol,所以转移电子的物质的量为16mol。2与FeCl2和KSCN混合溶液的反应实验,离子检验,根据元素价态判断发生的反应,电子转移数目的确定
本题难度:一般