微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关原电池的说法正确的是
[? ]
A.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe = 3Fe2+设计为原电池,则可用Zn为负极,Fe为正极,FeCl3为电解质
参考答案:B
本题解析:
本题难度:一般
2、填空题 (12分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)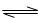 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=?。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=?。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图14所示。(已知: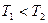 )
)
①反应2NO(g)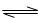 N2(g)+O2(g)为(填“吸热”或“放热)?反应。
N2(g)+O2(g)为(填“吸热”或“放热)?反应。
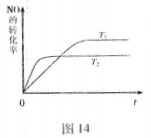
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号)?。
N2(g)+O2(g)已达到平衡的是(填序号)?。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g)?△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H3=-867kJ·mol-1
△H2=?.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO2)转化为无毒气体,该反应的化学方程式为?。
参考答案:
(1)0.11(1/9给分)? ………………………………………………2分
(2)①放热?………………………………………………………2分
②bc? …………………………………………………………2分
(3)①-1160 kJ·mol-1? ………………………………………………………3分
(不写单位、“-”扣1分)
② 2x CO + 2NOx ?2x CO2 + N2? ………………………………………3分
?2x CO2 + N2? ………………………………………3分
本题解析:略
本题难度:一般
3、选择题 下列事实不能用电化学原理解释的是
A.常温条件下,在空气中铝不容易被腐蚀
B.镀锌铁片比镀锡铁片更耐腐蚀
C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜
D.远洋海轮的尾部装上一定数量的锌板
参考答案:A
本题解析:铝是活泼的金属,在其表明极易被氧化生成一层致密的氧化膜,所以铝制容器是耐腐蚀的,和电化学原理无关系。其余选项BCD都是和原电池原理有关系即都是和电化学原理有关的,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对电化学原理应用的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力。试题贴近高考,基础性强,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
4、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
参考答案:(1)硝酸银 ,氧化反应, Cu -2e-=Cu2+
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知铜是负极,失去电子,凡是氧化反应,电极反应式是Cu -2e-=Cu2+。银离子在正极得到电子,因此电解质溶液应该是硝酸银溶液。
考点:考查根据原电池的判断和电极反应式的书写
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
5、选择题 NaBH4/H2O2燃料电池(DBFC)的结构如下图,有关该电池的说法正确的是
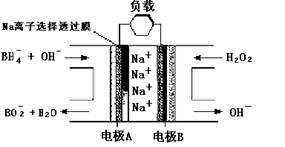
A.电极B是燃料电池的负极
B.电池的电极A反应为:BH4-+8OH--8e-===BO2-+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。NaBH4在反应中失去电子,所以A是负极。双氧水得电子,因此B是正极。所以AC不正确,B正确。1mol双氧水在反应中得到2mol电子,所以D中应该转移12电子,不正确。答案选B。
本题难度:一般