| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《原电池原理》考点预测(2017年强化版)(八)
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙  丙。则: 丙。则:①写出上述反应的化学方程式 。 ②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为 ③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。 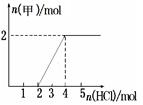 参考答案:Ⅰ.①FeCl3+3H2O 本题解析:Ⅰ.①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,则甲发生a反应的化学方程式为:FeCl3+3H2O 本题难度:困难 4、填空题 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。 参考答案: 本题解析: 本题难度:困难 5、填空题 (6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。 参考答案:(6分) (1) CH4(g)+H2O(g) 本题解析:(1)根据盖斯定律,I+II可得所求的热化学方程式,所以CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质的组成.. | |